��Ŀ����
С����ʵ���ҷ���һƿ�������ƹ���û������ƿ����������������ͬѧһ�����ƿ�������ƹ���չ��̽��������������һ�����̽����
��������⡿��ƿ�������ƹ����Ƿ���ʣ�
���������ϡ�CaCl2��Һ�����ԡ�
����������衿
����������û�б��ʣ��ڸ��������Ʋ��ֱ��ʣ��۸��������� ��
�����ʵ�顿ȡ�������ƹ�����Ʒ����ˮ�����ҺA����������ʵ�飺
| ʵ�鲽�� | ʵ������ | ���ۼ����� |
| ��1��ȡ������ҺA���Թ��У������еμ�������ϡ��� | �����ݲ��� | ���� ������ |
| ��2����ȡ������ҺA���Թ��У������еμ��������Ȼ�����Һ�� | ���� | ��Ӧ�Ļ�ѧ����ʽΪ�� |
| ��3�������裨2�����õĻ��Һ���ã����ϲ���Һ�еμ���ɫ�ķ�̪��Һ�� | ��Һ�ʺ�ɫ | ���� ���� |
����˼�뽻����
���õ��������Ʊ��ʵ�ԭ���ǣ��û�ѧ����ʽ��ʾ�� ����ˣ���������Ӧ ���档
��̽������չ��Ϊ��һ��̽���������Ƶı��ʳ̶ȣ�С����ȡ18.6g�������ƹ�����Ʒ�����ձ��У���������μ���ϡ���ᣬ�����ٲ�������Ϊֹ��������ϡ����100g����Ӧ��Ƶ��ձ�����Һ������Ϊ114.2g���Լ��㣺
��1������Ʒ��̼���Ƶ�����Ϊ ��
��2�����������Ƶı��ʳ̶ȣ������ʵ���������ռ����ǰ���������Ƶ�����������Ϊ ��
����������衿��ȫ������
�����ʵ�顿ʵ�鲽�� ʵ������ ���ۼ����� ��1�� �� ��2�� ��ɫ���� Na2CO3+ CaCl2=CaCO3��+2NaCl ��3�� ��
����˼�뽻����CO2+ 2NaOH = Na2CO3 + H2O���ܷ�
��̽������չ����1��10.6 ��2��50%
�����������������������衿�������룺����������û�б��ʣ��ڸ��������Ʋ��ֱ��ʣ��۸���������ȫ������
�����ʵ�顿����Ϊ̼���������ᷴӦ���ɶ�����̼���������ݣ�Na2CO3+2HCl=2NaCl+H2O+CO2����������������Ȼ��Ҳ���ᷴӦ����û���������ɣ�NaOH+HCl=NaCl+H2O�����Ը������������ݲ�����˵����̼���ƴ��ڣ��ʲ���ٲ��������ڲ��裨2���еμ��������Ȼ�����Һ����Һ�е�̼���ƻ����Ȼ��Ʒ�Ӧ��CaCl2+Na2CO3=CaCO3��+2NaCl�����������˰�ɫ�������������ӵ��Ȼ�����Һ��������������Һ�е�̼����ȫ����Ӧ���ˣ����ڲ��裨3���н����裨2�����õĻ��Һ���ã����ϲ���Һ�еμ���ɫ�ķ�̪��Һ�������Һ�ʺ�ɫ��˵����Һ��Ȼ�ʼ��ԣ�Ҳ����˵��Һ����NaOH�����Բ���ڳ�������Һ���ֱ���
����˼�뽻���������õ��������ƻ����տ����еĶ�����̼�����ʣ���ѧ����ʽΪ��CO2+ 2NaOH = Na2CO3 + H2O����ˣ���������Ӧ�ܷⱣ��
��̽������չ�������������غ㶨�ɣ��μӻ�ѧ��Ӧ�ĸ����ʵ������ܺͣ����ڷ�Ӧ�����ɵĸ����ʵ������ܺͣ����Կ���ֱ���ж����ɵĶ�����̼��������=18.6g+100g-114.2g=4.4g���ٸ��ݻ�ѧ��Ӧ����ʽ��Na2CO3+2HCl=2NaCl+H2O+CO2���ж�����̼��̼���Ƶ�������ϵ������̼���Ƶ�������Ȼ���ٸ��ݻ�ѧ��Ӧ����ʽ��CO2+ 2NaOH = Na2CO3 + H2O��̼������NaOH��������ϵ������ʵ�NaOH��������һ����������������Ƶı��ʳ̶�
�⣺��̼���Ƶ�����Ϊx�����ʵ�NaOH����Ϊy
Na2CO3+2HCl=2NaCl+H2O+CO2��
106 44
x 4.4g
��1��106��44=x��4.4g ��x=10.6g
��ԭ������δ���ʵ�NaOH����=18.6g-10.6g=8g
CO2+ 2NaOH = Na2CO3 + H2O
80 106
y 10.6g
��2��80��106=y��10.6g ��y=8g
�ʸ��������Ƶı��ʳ̶�=8g��(8g+8g)��100%=50%
���㣺�������Ƶı��ʵ�̽��,̼���ƵĻ�ѧ����,���ݻ�ѧ����ʽ���еļ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д���8�֣�����ˮɹ�Ρ�����õĴ����У���������ɳ�������������⣬�������Ȼ�þ���Ȼ��Ƶȿ��������ʣ�ij��ѧС��Ϊ�õ��ϴ�����ʳ�Σ�����������ʵ��̽�������������ǵ�̽�����
[�������]��λ�ýϴ���ʳ�ξ��壿
[��������]
20��ʱ���������ʵ��ܽ���
������±���ʾ��
| | OH- | CO32- |
| Na+ | �� | �� |
| Ca2+ | | �� |
| Mg2+ | �� | |
[ʵ�鷽��]�����·��������ᴿ���Ρ�

[���������]
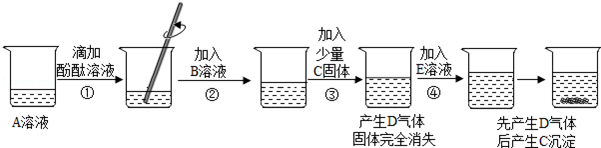
��1��ʵ�����X�������� ������D�� ��
��2��Ϊ�ﵽ��ȥ���������ʵ�ʵ�鲽���� ��������ţ�
��3��ʵ�鲽��۵���ҪĿ���� ���û�ѧ����ʽ�ش𣩣��ж�����������Һ�ѹ����ķ����� ��
��4���ڽ���ʵ�鲽��ݵ�����ʱ��Ϊ��ֹҺ��ɽ��ͻ����Ը�����ʳ�ξ�����Ҫ���еIJ����� ��
[��˼������]
��5����ͬѧ��Ϊ��ʵ�鷽���������ƣ������ɼ��貹���ʵ������� ��
ij��ѧѧϰС���ͬѧΧ�ơ�����ʯ��ˮ��̼������Һ�ķ�Ӧ��չ��������̽�����
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ_______________________________________��
(2)��Ӧ����Һ�е�������ʲô��ͬѧ��һ����Ϊ������������������������ƺ��������ƣ����������ƺ�̼���ƣ���____________________________��
(3)С��ȡ������Һ���Թ��У��μӹ���ϡ���ᣬ���������ݲ�����˵�����________(�����)�Dz����ܵġ�
Ϊ�˽�һ��ȷ����Һ�ijɷ֣�ͬѧ�����������ʵ�鷽����
| ʵ�鲽�� | �� �� | �� �� |
| | | �������ȷ |
С��ѡ��������һ�ֲ�ͬ��������________________________________(�ѧʽ)��Ҳ�õ���ͬ���Ľ��ۡ���ͬѧ�ǵĺ����£�����˳�������̽������
ij��ѧ����Χ�ơ�����кͷ�Ӧ������ѧ���ֳ�����С�飬����ʦ�����¿�չ̽����������ǽ�ѧƬ�Σ��������ѧϰ��������д�ո�(�������пո�)��
����ʾʵ�顿��һ������ϡ������뵽ʢ��NaOH��Һ��С�ձ��С�
��ѧ�����ݡ��÷�Ӧ�Ļ�ѧ����ʽ______________��
��������⡿ʵ����δ�۲쵽����������ͬѧ���������ʣ���Ӧ����Һ��������ʲô��?
��������롿������ʣ���ҷ�������롣����ͬѧ�IJ������£�
����һ��ֻ��Na2SO4
���������Na2SO4��H2SO4
����������Na2SO4��NaOH
�����ģ���Na2SO4��H2SO4��NaOH
����ͬѧ�����ϲ���������ɣ���Ϊ��һ�ֲ����Dz������ġ��������IJ�����
____________________��
��ʵ��̽����(1)����ͬѧȡ�ձ��е���Һ�������Թ��У��μӼ���CuSO4��Һ�������Ա仯����Һ��һ��û��____________��
(2)Ϊ����֤������룬��ѧϰС�������ձ��е���Һ����ѡ����ʦ�ṩ��pH��ֽ��ͭƬ��BaCl2��Һ��Na2CO3��Һ��������������������̽����
| ʵ�鷽�� | ����ҺpH | �μ�Na2CO3��Һ | �μ�BaCl2��Һ |
| ʵ����� |  | 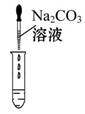 | 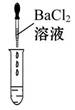 |
| ʵ������ | ��ֽ��ɫ���Աȱ�ɫ����pH<7 | | ������ɫ���� |
| ʵ����� | ��Һ����H2SO4 | ��Һ����H2SO4 | ��Һ����H2SO4 |
���ó����ۡ�ͨ��̽����ȫ��ͬѧһ��ȷ�����������ȷ�ġ�
�����۷�˼����ʦ��ͬѧ�����ö��ַ�������̽�������ҵó���ȷ���۸���϶���ͬʱָ����ʵ��̽����(2)�д����������Դ������ҷ�˼��ͬѧ�Ǿ�����˼����������������
(1)ʵ������еĴ�����____________________��
(2)ʵ�鷽����Ҳ��һ���Ǵ���ģ������ԭ����_____________________��
С÷ͬѧ�ڼ�����������������������������ʱ��������м���һ�ְ�ɫ��ĩ�������ͷۣ���������������ɶ�ף����ܸ���Ȥ��Ū���ף����ͷ�Ϊʲô������������������ɶ���أ�����һͬ����С÷��̽����
��������⡿С÷Ҫ̽������������ ����
���������ϡ����ͷ۵���Ҫ�ɷ���̼�����ƣ��׳�С�մ�������ˮ����������Һ����ʱ���ֽܷ⣬����һ���Ρ�һ�������ˮ��
��ʵ��̽����С÷������ʵ�鷽��̽��С�մ����ȷֽ�IJ��
| ʵ�鲽�� | ʵ������ | ʵ����� |
| 1��ȡ����С�մ�������Թ��м��ȣ��������ɵ�����ͨ�����ʯ��ˮ | ��1���Թܿڴ���Һ������ ��2������ʯ��ˮ����� | ��1�����ɵ�Һ����ˮ ��2�����ɵ��������� ����д��ѧʽ�� |
| 2��ȡ������ּ��Ⱥ��ʣ���������ˮ������ϡ���� | �� �� | ���ɵ�����̼���� |
��ʵ����ۡ�С�մ����ȷֽ�������������������γ�����С���ң�ʹ��������������ɶ�ף���ôС�մ����ȷֽ�Ļ�ѧ����ʽ���� ����
����չ���졿С��������Ϸ��֣���NaHCO3+NaOH=Na2CO3+H2O����������������ˮ��С���NaOH��Һ��NaHCO3��Һ��Ϻ�ȴ�������������������ʣ������������Ƿ����˻�ѧ��Ӧ������ʦ�����£����Ƿֱ�ͨ������2��ʵ��֤��NaOH��Һ��NaHCO3��Һ��ȷ�����˷�Ӧ������1�ͷ���2��ʵ�����û�������
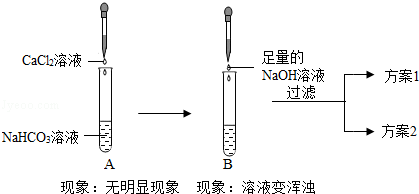
��ʵ��1��֤����Ӧ������Na2CO3��
С����Ϊ��B����Һ����ǣ�����֤����Na2CO3���ɣ�ϸ�ĵ�С÷��Ϊ�ý��۲��ԣ����������� ����С÷������ͼ��ʵ�飬������˷���1��֤����Ӧ��������Na2CO3����ô����1�ǣ�Ҫ��д��ʵ�鲽�衢����ͽ��ۣ��� ����
��ʵ��2����֤����Ӧ��NaHCO3�����ڣ�
С��������ͼ��ʵ�飬������˷���2��֤����Ӧ��NaHCO3�����ڣ���ô����2�ǣ�Ҫ��д��ʵ�鲽�衢����ͽ��ۣ��� ����
���ܽ���ɡ�ͨ��ʵ��1��ʵ��2˵��������û����������Ļ�ѧ��Ӧ�����Դ�������ͬ�Ƕ�֤����Ӧ�ķ������������Ƕ��ǣ�һ���� ���������� ����
ijͬѧ��������ͼ��ʾ��ʵ�飬��14.6%��ϡ�����м���̼��ƣ������10.6%��̼������Һ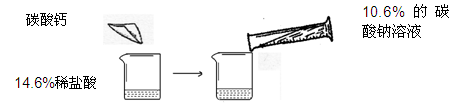
| | ��һ�� | �ڶ��� |
| 14.6%��ϡ��������� | m | m |
| ����̼��Ƶ����� | 10g | 20g |
| ����10.6%��̼������Һ������ | 100g | 200g |
| ����̼������Һ��ʵ������ | ֻ������ | ֻ�а�ɫ���� |
д��ʵ��һ�з�����ѧ��Ӧ�ķ���ʽ
��һ��ʵ���м���̼��ƺ���Һ�����ʳɷ�
������֪�����г����ڶ���ʵ�����ɳ����������ı���ʽ
ʵ���м���ϡ����m������Ϊ
�����ڶ��η�Ӧ�����Һ����191.2gˮ�������ò�������Һ�����ʵ���������Ϊ
����������������29.2%��Ũ��������ʵ�������ϡ���ᣬ����Ҫ��ˮ������



 �ش��������⣺
�ش��������⣺