题目内容
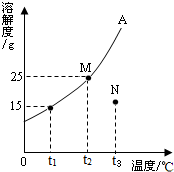 如图是A物质(不含结晶水)的溶解度曲线.
如图是A物质(不含结晶水)的溶解度曲线.(1)A物质的溶解度随随的升高而
(2)在t2℃时,将15gA物质放入50g水中,搅拌,充分溶解后,形成的溶液溶质质量分数为
(3)N点表示t3℃时A物质的
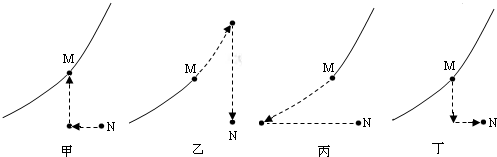
(4)如下是M、N两点代表的溶液相互转化的途径路线图(“…>”表示转化方向).
其中,采取“先将M点溶液加入一定量的水后,然后再升高温度至N点对应的温度”这一措施来实现M→N转化的途径路线如图是
分析:(1)根据A物质的溶解度曲线线型,判断该物质溶解度随温度变化而改变的情况;
(2)查出t2℃时,A物质的溶解度,由此判断将15gA物质放入50g水中是否可以完全溶解,并计算所得溶液的溶质质量分数;
(3)根据溶解度曲线下方的点表示该点为此温度的该物质的不饱和溶液,判断N点溶液的状态;
(4)根据点左右平移为温度改变、上下垂直移动为温度不变而溶液组成改变,分析M点与N点的转化关系.
(2)查出t2℃时,A物质的溶解度,由此判断将15gA物质放入50g水中是否可以完全溶解,并计算所得溶液的溶质质量分数;
(3)根据溶解度曲线下方的点表示该点为此温度的该物质的不饱和溶液,判断N点溶液的状态;
(4)根据点左右平移为温度改变、上下垂直移动为温度不变而溶液组成改变,分析M点与N点的转化关系.
解答:解:(1)物质A的溶解度曲线呈“上升型”,说明该物质的溶解度随温度升高而增大;
(2)t2℃时,A物质的溶解度25g,即此时100g水最多能溶解25gA,因此,此时将15gA物质放入50g水中,A物质不能全部溶解,得到该溶液下的饱和溶液,则该饱和溶液的溶质质量分数=
×100%=20%;
(3)N点位于t3℃时A物质溶解度曲线下方,表明N点所表示的溶液为该温度下A物质的不饱和溶液;
(4)先将M点溶液加入一定量的水后,M点向下移动;然后再升高温度至N点对应的温度,M点向右平移至N点;这一措施来实现M→N转化的途径路线与图丁所示一致;根据溶解度曲线图中N、M点位置关系,实现N→M转化可采取:先降温到t2℃,使N点向左平移;再向溶液中加入适量溶质固体或再恒温蒸发溶剂,使N点向上垂直移动至M;
故答案为:(1)增大;
(2)20%;
(3)不饱和;
(4)丁;先降温到t2℃,再向溶液中加入适量溶质固体或再恒温蒸发溶剂.
(2)t2℃时,A物质的溶解度25g,即此时100g水最多能溶解25gA,因此,此时将15gA物质放入50g水中,A物质不能全部溶解,得到该溶液下的饱和溶液,则该饱和溶液的溶质质量分数=
| 25g |
| 100g+25g |
(3)N点位于t3℃时A物质溶解度曲线下方,表明N点所表示的溶液为该温度下A物质的不饱和溶液;
(4)先将M点溶液加入一定量的水后,M点向下移动;然后再升高温度至N点对应的温度,M点向右平移至N点;这一措施来实现M→N转化的途径路线与图丁所示一致;根据溶解度曲线图中N、M点位置关系,实现N→M转化可采取:先降温到t2℃,使N点向左平移;再向溶液中加入适量溶质固体或再恒温蒸发溶剂,使N点向上垂直移动至M;
故答案为:(1)增大;
(2)20%;
(3)不饱和;
(4)丁;先降温到t2℃,再向溶液中加入适量溶质固体或再恒温蒸发溶剂.
点评:根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况,可以比较在一定温度范围内的物质的溶解度大小,可以判断某温度下物质的溶解度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 实验探究让化学更具魅力,请帮助完成下列实验探究
实验探究让化学更具魅力,请帮助完成下列实验探究