题目内容
有关实验操作,不能达到预期目的是( )A.用10mL量筒量取8.2mL水
B.用电子天平称取5.6g氧化铜粉末
C.用排水集气法可得到比较纯净的氧气
D.用5mL水和5mL酒精配制成10mL酒精溶液
【答案】分析:A、用量筒量取一定体积的液体,要选择和量筒容量接近的量筒,以减少误差.
B、电子天平的精确度为0.1g.
C、根据氧气的密度和水溶性选择收集方法,题中要求收集纯净氧气.
D、由于液体的密度不同,所以溶液的体积一般没有加和性.
解答:解:A、正确,因为量筒量取一定体积的液体时,要选择和量筒容量接近的量筒.
B、正确,电子天平的精确度为0.1g,可以称取5.6g.
C、正确,用排水法可以收集比较纯净的氧气.
D、错误,由于酒精和水的密度不相等,所以混合后体积不是10mL.
故选D
点评:本题主要对常用仪器的使用方法和称量容器的精确度进行考查,在实验记录数据时必须依据所选仪器的精确度进行记录,否则数据就没有意义了.
B、电子天平的精确度为0.1g.
C、根据氧气的密度和水溶性选择收集方法,题中要求收集纯净氧气.
D、由于液体的密度不同,所以溶液的体积一般没有加和性.
解答:解:A、正确,因为量筒量取一定体积的液体时,要选择和量筒容量接近的量筒.
B、正确,电子天平的精确度为0.1g,可以称取5.6g.
C、正确,用排水法可以收集比较纯净的氧气.
D、错误,由于酒精和水的密度不相等,所以混合后体积不是10mL.
故选D
点评:本题主要对常用仪器的使用方法和称量容器的精确度进行考查,在实验记录数据时必须依据所选仪器的精确度进行记录,否则数据就没有意义了.

练习册系列答案
相关题目
(8分)人类的生存离不开氧气。某校化学兴趣小组的同学在老师的指导下做了有关氧气的系列探究实验。
探究一:某化学兴趣小组的同学对空气中氧气含量的测定实验进行探究。
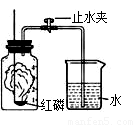 ⑴如右图所示装置和药品进行实验,反应的化学式表
⑴如右图所示装置和药品进行实验,反应的化学式表
达式是: 。
⑵小明同学认为可用铁丝代替红磷测定空气中氧气的
含量,小丽同学认为不可以,其原因是:
。
⑶小芳同学用木炭代替红磷来测定空气中氧气的含量。
结果却发现水几乎没有倒吸。小组内同学帮她仔细检
查,发现装置的气密性及操作步骤均无问题。你认为
造成此现象的原因是 。
⑷小组内同学反思上述实验的探究过程后认为:用燃烧法测定空气中氧气含量的实验时,在药品的选择或生成物的要求上应考虑的是: 。
探究二:以下是该小组探究影响H2O2溶液反应速率部分因素的相关实验数据。
|
实验序号 |
H2O2溶液浓度% |
H2O2溶液体积/mL |
温度/℃ |
MnO2的用量/g |
收集氧气的体积/mL |
反应所需 的时间/s |
|
① |
5 |
1 |
20 |
0.1 |
4 |
16.75 |
|
② |
15 |
1 |
20 |
0.1 |
4 |
6.04 |
|
③ |
30 |
5 |
35 |
0 |
2 |
49.21 |
|
④ |
30 |
5 |
55 |
0 |
2 |
10.76 |
⑴写出实验室用H2O2溶液和MnO2混合制氧气的化学式表达式:_________________。
⑵通过实验①和②对比可知,化学反应速率与____________有关;
从实验③和④对比可知,化学反应速率与温度的关系是:______________________。
⑶通过上述实验____(填“能”或“不能”)说明使用MnO2可以加快H2O2溶液反应速率。

 、
、 、
、 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:


 、
、 、
、 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下: