题目内容
1909年化学家哈伯在实验室首次将氮气和氢气在一定条件下合成了氨(NH3).常温下,氨是一种无色有刺激性气味的气体,密度小于空气,极易溶解于水,氨和氧气在铂催化剂和一定温度下反应产生一氧化氮和水.
(1)从以上信息中你能总结出氨的物理性质是______(写出一条即可);
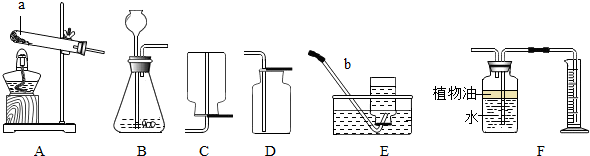
(2)如图为实验室制取气体常使用的实验装置:

在实验室中,常用加热氯化铵(固体)和熟石灰(固体)混合物的方法制取氨气.
①采用上述方法制取氨气应选择______(填装置序号)作为气体的发生装置;
②同学们一致认为,选择C装置收集氨气不合理,理由是______.
③装置A除用作某些气体的发生装置外,还可进行其它实验,如______(请举一例加以说明).
(3)2007年化学家格哈德?埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,获得诺贝尔化学奖.
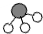
 、
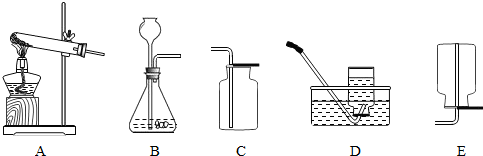
、 、
、 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:

①观察上图,可发现合成氨反应过程的顺序为:E→______→______→______→C(在括号中填写其它三张图示的序号);
②综合以上五张图示,你能总结出的有关化学反应的一条结论是:______.
(4)某研究性学习小组尝试利用氨气进行“微粒的基本性质”的实验探究,实验过程如下:
a.将干燥的集气瓶B充满与大气压强相等的干燥氯化氢气体并组装成如图1所示的实验装置(K3处于关闭状态至操作b 完成为止);
b.通过调节活塞K1、K2,在干燥的集气瓶A中充满与大气压强相等的干燥氨气,其操作是:打开K1、K2,在______(选填“K1”或“K2”)处导管口通入干燥的氨气;
c.集满氨气后,关闭K1、K2,再打开K3,一段时间后两只集气瓶中都出现白烟(氯化氢气体与氨气反应产生氯化铵固体的细小颗粒).
①写出c步实验中所发生的反应的化学式表达式______;
②上述c步实验中出现的现象说明______.
(5)近期发生的“三鹿”婴幼儿奶粉事件,敲响了食品安全的警钟.国家规定:每100g婴幼儿奶粉中蛋白质必须达12g-25g.为了测定奶粉中蛋白质的含量,可采用“盖尔达法”分解其中的蛋白质.其原理是把蛋白质中的氮元素完全转化为氨气,再用稀硫酸吸收氨气.
①蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收.丙氨酸(化学式为C3H7O2N)就是一种氨基酸,丙氨酸中C、H、O、N各元素的质量比为______.
②蛋白质的代谢产物主要是尿素[CO(NH2)2],若从食物中摄取的蛋白质经体内新陈代谢后完全转化为尿素排出体外,每人每天相当于排出尿素30g.30g尿素中含氮元素______g.
③图2是某奶粉包装袋上的部分文字说明.现取该奶粉样品100g,用“盖尔达法”分解其中的蛋白质,产生氨气的质量为3.74g.

通过计算说明:该奶粉包装袋上所注蛋白质的含量是否真实(蛋白质含氮元素的质量分数为16%)?
解:(1)由题干信息可知,氨气的物理性质为:常温下,氨是一种无色有刺激性气味的气体,密度小于空气,极易溶解于水;
(2)实验室常用加热氯化铵(固体)和熟石灰(固体)混合物的方法制取氨气,应选择“固固加热”装置A;氨气密度比空气小,不能用C装置收集氨气;A装置还可以用于加热碳酸氢铵;
(3)①分析题中五个图是准确解答本题的核心.
图A所示为附在催化剂表面的原子,此图应该是变化中分解成原子的一个过程;
图B中形成了氨气分子,应为原子重新组合成新分子的过程;
图C表示出新分子与催化剂分离,应为变化过程的最后环节;
图D中分子仍然为原反应物的分子,和图⑤相比较,可判断是反应物与催化剂相结合的一个过程;
图E中的分子仍为氮气分子和氢气分子,且反应物分子还没接触到催化剂,此图应表示反应最初的过程;
所以合成氨的顺序为:E→D→A→B→C;
②综合以上五张图示,你能总结出的有关化学反应的结论是:化学变化中分子可分,原子不可分或化学变化中,原子的个数和种类不变等;
(4)b、氨气的密度比空气小,应用向下排空气法收集氨气,所以在K1处导管口通入干燥氨气;
①氯化氢气体与氨气反应产生氯化铵的反应的化学方程式是NH3+HCl=NH4Cl;
②上述c步实验中出现的现象说明微粒(或分子)是不断运动的;
(5)①丙氨酸中C、H、O、N素的质量比(12×3):(1×7):(16×2):14=36:7:32:14.
②由尿素的化学式为CO(NH2)2,则30g尿素中氮元素的质量为30g× ×100%=14g.
×100%=14g.
③3.74gNH3中氮元素的质量=3.74g×( ×100%)=3.08g;
×100%)=3.08g;
含氮元素3.08g的蛋白质的质量=3.08g÷16%=18.1g;
 ×100%=18.1%,所以该奶粉包装袋上所注蛋白质的含量不真实;
×100%=18.1%,所以该奶粉包装袋上所注蛋白质的含量不真实;
故答案为:
(1)常温下,氨是一种无色有刺激性气味的气体;
(2)①A;②氨气的密度小于空气;③加热碳酸氢铵;
(3)①DAB;②化学反应前后,原子的种类和个数均不变;
(4)K1;①NH3+HCl=NH4Cl;②微粒(或分子)是不断运动的;
(5)①36:7:32:14;②14;③3.74gNH3中氮元素的质量=3.74g×( ×100%)=3.08g;
×100%)=3.08g;
含氮元素3.08g的蛋白质的质量=3.08g÷16%=18.1g;
 ×100%=18.1%,所以该奶粉包装袋上所注蛋白质的含量不真实.
×100%=18.1%,所以该奶粉包装袋上所注蛋白质的含量不真实.
分析:(1)根据题干信息来分析解答;
(2)根据实验室制取氨气的反应原理和氨气的性质来解答;
(3)根据化学变化的实质为:反应物的分子在一定条件下被破坏,分解成原子,然后这些原子重新组合成新的分子解答;
(4)根据氨气的物理性质和化学性质解答.
(5)①根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
②根据尿素的化学式及尿素的质量来计算氮元素的质量;
③根据氨气的质量计算出氮元素的质量,从而计算奶粉中蛋白质的质量分数,并与图对比,判断是否真实.
点评:本题考查氨气的性质、实验室制取装置的选择、化学反应实质,综合性强,要加强根据题意,抽取信息进行解题的能力.
(2)实验室常用加热氯化铵(固体)和熟石灰(固体)混合物的方法制取氨气,应选择“固固加热”装置A;氨气密度比空气小,不能用C装置收集氨气;A装置还可以用于加热碳酸氢铵;
(3)①分析题中五个图是准确解答本题的核心.
图A所示为附在催化剂表面的原子,此图应该是变化中分解成原子的一个过程;
图B中形成了氨气分子,应为原子重新组合成新分子的过程;
图C表示出新分子与催化剂分离,应为变化过程的最后环节;
图D中分子仍然为原反应物的分子,和图⑤相比较,可判断是反应物与催化剂相结合的一个过程;
图E中的分子仍为氮气分子和氢气分子,且反应物分子还没接触到催化剂,此图应表示反应最初的过程;
所以合成氨的顺序为:E→D→A→B→C;
②综合以上五张图示,你能总结出的有关化学反应的结论是:化学变化中分子可分,原子不可分或化学变化中,原子的个数和种类不变等;
(4)b、氨气的密度比空气小,应用向下排空气法收集氨气,所以在K1处导管口通入干燥氨气;
①氯化氢气体与氨气反应产生氯化铵的反应的化学方程式是NH3+HCl=NH4Cl;
②上述c步实验中出现的现象说明微粒(或分子)是不断运动的;
(5)①丙氨酸中C、H、O、N素的质量比(12×3):(1×7):(16×2):14=36:7:32:14.
②由尿素的化学式为CO(NH2)2,则30g尿素中氮元素的质量为30g×
 ×100%=14g.
×100%=14g.③3.74gNH3中氮元素的质量=3.74g×(
 ×100%)=3.08g;
×100%)=3.08g;含氮元素3.08g的蛋白质的质量=3.08g÷16%=18.1g;
 ×100%=18.1%,所以该奶粉包装袋上所注蛋白质的含量不真实;
×100%=18.1%,所以该奶粉包装袋上所注蛋白质的含量不真实;故答案为:
(1)常温下,氨是一种无色有刺激性气味的气体;
(2)①A;②氨气的密度小于空气;③加热碳酸氢铵;
(3)①DAB;②化学反应前后,原子的种类和个数均不变;
(4)K1;①NH3+HCl=NH4Cl;②微粒(或分子)是不断运动的;
(5)①36:7:32:14;②14;③3.74gNH3中氮元素的质量=3.74g×(
 ×100%)=3.08g;
×100%)=3.08g;含氮元素3.08g的蛋白质的质量=3.08g÷16%=18.1g;
 ×100%=18.1%,所以该奶粉包装袋上所注蛋白质的含量不真实.
×100%=18.1%,所以该奶粉包装袋上所注蛋白质的含量不真实.分析:(1)根据题干信息来分析解答;
(2)根据实验室制取氨气的反应原理和氨气的性质来解答;
(3)根据化学变化的实质为:反应物的分子在一定条件下被破坏,分解成原子,然后这些原子重新组合成新的分子解答;
(4)根据氨气的物理性质和化学性质解答.
(5)①根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
②根据尿素的化学式及尿素的质量来计算氮元素的质量;
③根据氨气的质量计算出氮元素的质量,从而计算奶粉中蛋白质的质量分数,并与图对比,判断是否真实.
点评:本题考查氨气的性质、实验室制取装置的选择、化学反应实质,综合性强,要加强根据题意,抽取信息进行解题的能力.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
 、
、 、
、 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序
分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面合成氨反应过程的顺序
 分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面
分别表示N2、H2、NH3.观察下图,写出符合在催化剂表面
 、
、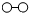 、
、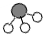 分别表示N2、H2、NH3.在催化剂表面(
分别表示N2、H2、NH3.在催化剂表面( 下图中表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
下图中表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
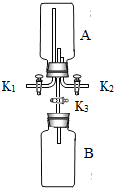 微粒的基本性质”的实验探究,实验过程如下:
微粒的基本性质”的实验探究,实验过程如下: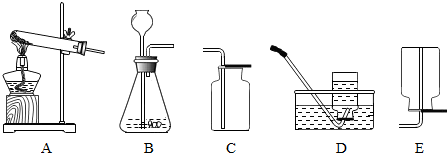
 、
、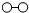 、
、 分别表示N2、H2、NH3.在催化剂表面(下图中
分别表示N2、H2、NH3.在催化剂表面(下图中 表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下:
表示催化剂表面)N2和H2反应合成氨的反应过程可用五张图表示如下: