题目内容
 为测定某盐酸的溶质质量分数,小荣同学取该盐酸样品50g,向其中加入过量锌粒,完全反应后手机到0.3g氢气,请完成下列计算与分析:
为测定某盐酸的溶质质量分数,小荣同学取该盐酸样品50g,向其中加入过量锌粒,完全反应后手机到0.3g氢气,请完成下列计算与分析:(1计算该盐酸的溶质质量分数.
(2)小荣将测定结果与盐酸试剂瓶标签(如图所示)所标的相关信息进行对比,发现标签上溶质的质量分数与实际测得的值不符)(实验过程无误),你认为原因可能是
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算,酸的物理性质及用途
专题:溶质质量分数与化学方程式相结合的计算
分析:根据生成氢气的质量可以计算稀盐酸中氯化氢的质量,进一步可以计算该盐酸的溶质质量分数;
盐酸易挥发,当盐酸中的氯化氢挥发后,会导致质量分数变小.
盐酸易挥发,当盐酸中的氯化氢挥发后,会导致质量分数变小.
解答:解:(1)设氯化氢的质量为x,
Zn+2HCl═ZnCl2+H2↑,
73 2
x 0.3g
=
,
x=10.95g,
该盐酸的溶质质量分数为:
×100%=21.9%,
答:该盐酸的溶质质量分数为21.9%.
(2)因为盐酸易挥发,氯化氢挥发后,溶质质量减小,会导致溶质质量分数减小.
故填:盐酸挥发.
Zn+2HCl═ZnCl2+H2↑,
73 2
x 0.3g
| 73 |
| x |
| 2 |
| 0.3g |
x=10.95g,
该盐酸的溶质质量分数为:
| 10.95g |
| 50g |
答:该盐酸的溶质质量分数为21.9%.
(2)因为盐酸易挥发,氯化氢挥发后,溶质质量减小,会导致溶质质量分数减小.
故填:盐酸挥发.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
为了减少空气污染,下列做法正确的是( )
| A、强行关闭废气排放不达标的工厂 |
| B、使用天然气作燃料 |
| C、禁止使用煤作燃料 |
| D、工业用水经处理后排放 |

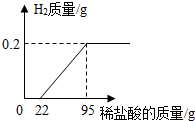 工业上常用稀盐酸除去钢铁表面的铁锈,某小组将一根表面锈蚀的铁钉投入到150g稀盐酸中(假设盐酸将铁锈消耗完后才与铁反应),反应数据如图所示.试求:
工业上常用稀盐酸除去钢铁表面的铁锈,某小组将一根表面锈蚀的铁钉投入到150g稀盐酸中(假设盐酸将铁锈消耗完后才与铁反应),反应数据如图所示.试求: