题目内容
【题目】化学核心素养之一是“证据推理与模型认知”,如图是“氮元素及其化合物的化合价与物质类别之间的关系图”。请回答下列问题:
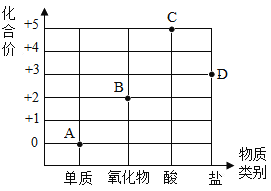
(1)写出 A 点所表示的物质的化学式 ___________。
(2)有一种物质的化学式为NaNO2,则该物质对应的图中的点应该是___________(填字母)。
(3)A 和氧气在一定条件下只生成 B,该反应属于___________(填基本反应类型);由此可知在化学反应前后一定发生变化的是___________(填字母)。
A 原子数目B 分子数目
C 物质种类D 反应前后物质的总质量
(4)二氧化氮气体有毒,易与水反应生成C 和B,其化学方程式为___________。
【答案】N2 D 化合反应 C ![]()
【解析】
(1)A点显示氮元素化合价为零价,故表示的是氮气,化学式为N2。
(2)NaNO2属于盐,NaNO2中,钠元素为+1价,氧元素为-2价,根据化合物各元素代数和为零,设氮元素化合价为x,则+1+x+(-2)×2=0,x=+3,则氮元素化合价为+3价,则该物质对应的图中的点应该是D。
(3)A 和氧气在一定条件下只生成 B,符合“多变一”特征,该反应属于化合反应;B点所示物质是NO,则反应的化学方程式为![]() ,则:
,则:
A、化学反应前后原子数目不变,不符合题意;
B、该反应反应前后中分子数目没有改变,不符合题意;
C、反应后生成了新物质,物质种类一定发生变化,符合题意;
D、反应前后物质的总质量不变,不符合题意;
故选:C。
(4)二氧化氮气体有毒,易与水反应生成C 和B,C点对应的物质是一种酸,其中氮元素显+5价,即硝酸,B是氧化物,其中氮元素显+2价,即NO;二氧化氮与水反应生成硝酸和一氧化氮,其化学方程式为![]() 。
。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】水和溶液在生产、生活中起着十分重要的作用,请回答下列问题。
(1)城市中的生活用水是经自来水厂净化处理过的。有时可利用____________ (填物质名称)溶于水后生成的胶状物对杂质的吸附,使杂质沉降来达到净水的目的。
(2)水是常见的溶剂,A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示。
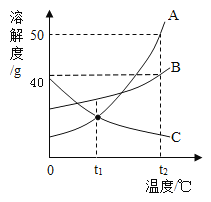
①t2℃时,A 的饱和溶液中溶质的质量分数为 ____________ (保留一位小数)
②下列说法正确的是(__________)
A. t2℃时,A、B、C 三种物质的溶解度大小为:A>B>C
B.将 t2℃时 A、B、C 的饱和溶液分別降温至 t1℃,所得溶液中溶质的质量分数大小为:B>A=C
C.从含有少量 B的 A的饱和溶液中得到较多的 A 晶体,通常可采用冷却热饱和溶液的方法
(3)压强为 101 kPa 和温度为 0℃时,氮气在水中的溶解度为 0.024,这句话的含义是______ 。
(4)下图实线方框内是化学反应的类型,相邻虚线方框内是对应的一个有水参加的反应的 化学方程式,请在图中填空。
化合反应 | H2O+CO2=H2CO3 |
分解反应 | ____________ |
置换反应 | Fe+4H2O |
其它 | 6H2O+6CO2 |
(5)初中化学中,我们学习了稀盐酸和氢氧化钠溶液(如图所示)发生中和反应的实质是:H++OH= H2O,像这种用实际参加 反应的离子符号来表示反应的式子叫离子方程式。以稀盐酸和氢氧 化钠溶液反应为例,离子方程式的书写一般按以下步骤:
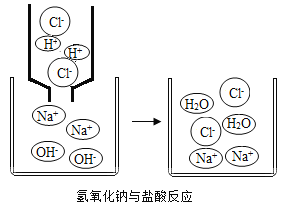
Ⅰ.写出稀盐酸与氢氧化钠溶液反应的化学方程式____________。
Ⅱ.把易溶于水且易电解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示。 上述方程式可改写成:H++Cl++Na++OH- = Na++Cl-+H2O;
Ⅲ.删去方程式两边不参加反应的离子,继续改写成:H++OH=H2O;
Ⅳ.检查方程式两边各元素的原子个数和电荷总数是否相等。则稀盐酸和氢氧化钠溶液反应的离子方程式为: H++OH- = H2O。请回答:
(6)写出稀盐酸和碳酸钙发生反应的离子方程式____________;
(7)酸、碱、盐在水溶液中发生的复分解反应实质上就是两种化合物在溶液中相互交换离 子的反应,生成物中有____________生成时,复分解反应才可以发生。
【题目】为了测定某石灰石中碳酸钙的质量分数,进行了如下实验:①在三个烧杯中都加入了10g样品;②向三个烧杯中加入质量不等、相同浓度的稀盐酸;③记录产生气体的质量。实验数据如下:
实验 | 加入稀盐酸的质量/g | W/g |
烧杯Ⅰ | 36.5 | 2.2 |
烧杯Ⅱ | 73 | 3.52 |
烧杯Ⅲ | 100 | 3.52 |
回答下列问题:
(1)样品中碳酸钙完全反应时,得到气体的质量为 g。
(2)样品中碳酸钙的质量分数是多少?