题目内容
【题目】为测定某NaCl、Na2CO3固体混合物的组成,小明同学取16g该混合物样品放入烧杯中,称得烧杯及所盛固体混合物的总质量98g,再把100g稀盐酸分四次平均分成四份依次加入盛有固体样品的烧杯中,每次都充分反应。实验数据如下表:

请分析以上数据后计算:
(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是____________;
(2)该固体混合物中碳酸钠的质量分数________?(要求写出计算过程)
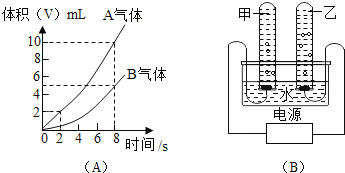
(3)根据实验数据,在右边的坐标纸上绘制出所加稀盐酸质量与生成气体质量关系的曲线________(不要求写出计算过程,只画出曲线即可)。
【答案】1.6g 66.25%(详见解析) 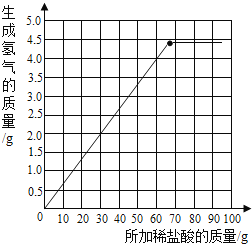
【解析】
将100g的称盐酸分四次加放每次加放25g,根据质量守恒,第一次加入25g后的总质量为123g,剩余质量为121.4g,放出二氧化碳的质量=123g -121.4g =1.6g;第二次加放25g后的总质量为148g,剩余质量为144.8g,放出二氧化碳的总质量=148g -144.8g =3.2g;第三次加入25g后的总质量为173g,剩余质量为168.6g,放出二氧化碳的总质量=173g -168.6g =4.4g;第四次加放25g后的总质量为198g,剩余质量为193.6g,放出二氧化碳的总质量=198g -193.6g =4.4g。
(1)第一次加入25g后的总质量为123g,剩余质量为121.4g,根据质量守恒可知,放出二氧化碳的质量=123g -121.4g =1.6g;
(2)根据以上分析可知,碳酸钠完全反应生成的二氧化碳质量为4.4 g;
设:样品中碳酸钠的质量为x。
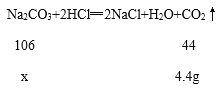
![]() x=10.6g;
x=10.6g;
该固体混合物中碳酸钠的质量分数=![]() ;
;
(3)每25g的稀盐酸与足量的样品反应生成二氧化碳1.6g,设:生成4.4g的二氧化碳所需稀盐酸的质量为y。则有:![]() ,y=68.8g;根据计算68.8g的稀盐酸与碳酸钠恰好完全反应生成4.4g的二氧化碳,当加入稀盐酸超过68.8g后,碳酸钠已经完全反应,二氧化碳气体的质量不再变化,可绘制出所加稀盐酸质量与生成气体质量关系的曲线如图所示:
,y=68.8g;根据计算68.8g的稀盐酸与碳酸钠恰好完全反应生成4.4g的二氧化碳,当加入稀盐酸超过68.8g后,碳酸钠已经完全反应,二氧化碳气体的质量不再变化,可绘制出所加稀盐酸质量与生成气体质量关系的曲线如图所示:

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】小李同学设计下表所示实验,探究金属铜对H2O2分解速率的影响.
操作 | 装置 | 现象 |
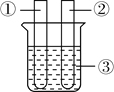
(1)取一个铜丝网,卷成筒形,固定在铁丝上. |
| |
(2)分别向①和②中注入15mL、30%的H2O2溶液,并放入盛有热水的③中。 |
| 约1min后可观察到①和②中都有少量气泡产生。 |
(3)把铜丝网(连同固定的铁丝)插入①中。 |
| ①中有大量气泡产生,5min后不再有气泡产生;此时②中仍然不断有少量气泡产生。 |
回答下列问题:
(1)仪器②中实验的目的是________。
(2)能否得出铜可以加快H2O2分解速率的结论________(填“是”或“否”)。
(3)如果用上述实验探究铜是不是H2O2分解的催化剂,需要对上述实验方案进行补充,其中必要的是________。
A.称量实验前铜丝网的质量和实验后干燥铜丝网的质量
B.向仪器②中加入二氧化锰
C.将实验后的铜丝网进行加热
D.将铁丝换成铜丝
E.将过氧化氢溶液加水稀释
(4)实验后确定铜可以加快H2O2分解的速率,请写出该反应的化学式表达式_______________。