题目内容
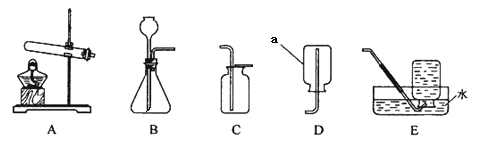
【题目】某燃料 X 在 7.2g 氧气中燃烧,得到 9.2g 混合气体(可能含有一氧化碳、二氧化碳、水蒸气)。化学兴趣小组的同学利用下图所示装置验证混合气体的成分。
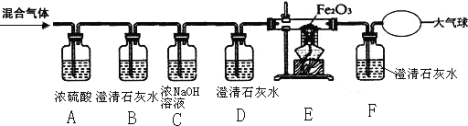
请回答下列问题:
(1)通过混合气体后,A 装置增重 4.5g,B 装置中澄清石灰水变浑浊,说明混合气体中含有___
(2)D 装置的作用是___。
(3)当观察到 E 中___,证明混合气体中有 CO。此时 F 中发生反应的化学方程式为___。
(4)实验结束后,同学们称量 B、C 装置共增重 3.3g,根据以上数据可确定燃料 X 中所含元素为___,其质量比为___。
【答案】H2O、CO2 检验二氧化碳是否被除尽 红色固体变成黑色 Ca(OH)2+CO2═CaCO3↓+H2O C、H 3:1
【解析】
(1)根据浓硫酸有吸水性、二氧化碳能使澄清的石灰水变浑浊进行分析;
(2)澄清的石灰水可以检验二氧化碳;
(3)根据一氧化碳具有还原性分析实验现象;
(4)根据B、C装置可以吸收二氧化碳,增重的质量即为二氧化碳的质量,据此计算元素的质量比。
(1)浓硫酸有吸水性,因此浓硫酸增重就说明吸收了水,因此混合气体中含有水蒸气;B装置中澄清石灰水变浑浊,说明含有二氧化碳;
(2)D装置的澄清石灰水可以检验氢氧化钠溶液是否吸收尽二氧化碳,便于对一氧化碳产生二氧化碳的检验;
(3)一氧化碳具有还原性,可以和氧化铁反应产生铁和二氧化碳,因此观察到的现象是红色固体变成黑色,F中石灰水变浑浊;
(4)B、C装置可以吸收二氧化碳,增重的质量即为二氧化碳的质量,说明二氧化碳的质量为3.3g,因为混合气体质量为9.2g,其中水蒸气为4.5g、3.3g二氧化碳,则生成一氧化碳的质量为1.4g,4.5g水中氢元素的质量为4.5g×![]() ×100%=0.5g,3.3g二氧化碳中碳元素的质量为3.3g×
×100%=0.5g,3.3g二氧化碳中碳元素的质量为3.3g×![]() ×100%=0.9g,1.4g一氧化碳中碳元素的质量为1.4g×
×100%=0.9g,1.4g一氧化碳中碳元素的质量为1.4g×![]() ×100%=0.6g,根据质量守恒定律燃料X的质量为9.2g-7.2g=2g,碳元素和氧元素的质量和为0.9g+0.6g+0.5g=2g,因此X中不含有氧元素,只含有碳、氢元素,因此两种元素的质量比为:(0.9g+0.6g):0.5g=3:1。
×100%=0.6g,根据质量守恒定律燃料X的质量为9.2g-7.2g=2g,碳元素和氧元素的质量和为0.9g+0.6g+0.5g=2g,因此X中不含有氧元素,只含有碳、氢元素,因此两种元素的质量比为:(0.9g+0.6g):0.5g=3:1。

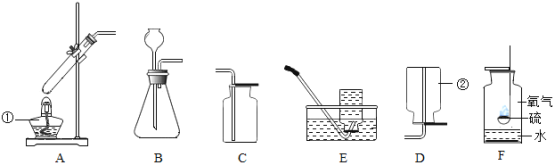
【题目】根据下列实验装置图,回答问题:
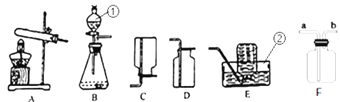
(1)写出上图所示装置中标有序号的仪器名称:①_______________ ② ______________。
(2)实验室用过氧化氢溶液和二氧化锰混合制取氧气,所选用的发生装置是________(选填装置序号,下同),请写出符号表达式:______________________,二氧化锰在该反应中的作用是_________。 若用F装置收集氧气,则验满的方法为____________________。
(3)甲烷是一种无色无味、难溶于水、密度比空气小的气体,实验室常用加热无水醋酸钠和碱石灰的固体混合物制取甲烷时,发生装置应选_________,若要收集一瓶干燥的甲烷气体,收集装置可选用____________(在“C、D、E”中选择)。
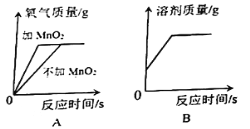
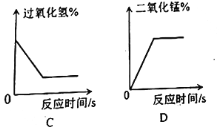
(4)下列图像表示在用过氧化氢溶液和二氧化锰的混合制取氧气的过程中某些量的变化趋势,其中能正确反应变化关系的是________ 。
(5)走进实验室,寻找新的催化剂。
(提出问题)红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
(实验探究)
实验步骤 | 实验现象 | 实验结论及解释 | |
I |
| A中无明显现象,B中产生大量能使带火星木条复燃的气体。 | 红砖粉能改变过氧化氢分解速率 |
II | B试管中重新加入5%的过氧化氢溶液,反应停止后,过滤分离出红砖粉,洗涤、干燥、称量 | B试管又产生大量能使带火星木条复燃的气体,滤渣的质量等于ag | 红砖粉末的____________在反应前后均没发生变化,能作为过氧化氢分解的催化剂。 |
III |
| 两支试管中均产生气泡,且___________________________________________。 | 红砖粉末的催化效果没有二氧化锰粉末好。 |
(拓展应用)
①实验中用到溶质质量分数为5%的过氧化氢溶液,若用10g溶质质量分数为30%的过氧化氢溶液来配制,加水的体积为____________mL。
②已知硫酸铜也可以作为过氧化氢分解的催化剂,向101.2g一定溶质质量分数的过氧化氢溶液中加入2g硫酸铜粉末。充分反应后得到溶质质量分数为2%的溶液,则生成氧气 _____g。
【题目】某同学利用“多米诺骨牌”效应,设计了如图气体制取与性质验证的组合实验,打开A中分液漏斗的活塞,很快看到E中导管口有气泡冒出,且溶液由紫色变红色。 请看图回答问题:
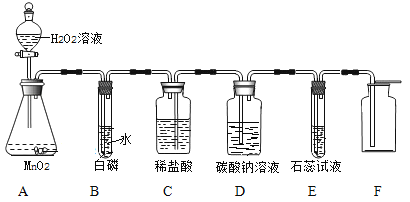
(1)A中反应的化学方程式 ;
B中白磷不燃烧,原因是 。
(2)C、D中看到的现象分别是 、
。
(3)用化学方程式表示E中颜色变化的原因 。
(4)将D中液体倒入试管中,对其成分进行探究:
实验操作 | 实验现象 | 结论 |
方法一:向试管中滴入 溶液 | 无色液体变白色浑浊 | 溶质中一定含有 碳酸钠和 |
方法二:向试管中放入镁条 | 气泡产生 |