��Ŀ����
����Ŀ����������װ��ͼ���ش��й����⡣
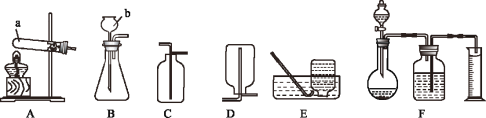
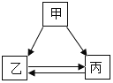
��1��д��װ��ͼ�б�����������ƣ�b_____��
��2��д��ʵ������п����ϡ������ȡ�����Ļ�ѧ����ʽ_____����ѡ�õķ���װ����_____������ĸ������Eװ���ռ�������ԭ����_____��
��3��ij��ȤС����ͼF��ʾװ���ռ���������Ӧ�������������������3��ʵ���ռ��������������ƽ��ֵ������ֵҪ�ߡ�����Ϊ�������ʵ��������Ҫԭ����_____��
��4��ʵ���Ҽ�������غͶ������̵Ļ����30g��ȡ��������ȫ��Ӧ��ʣ���������Ϊ20.4g�������ԭ�����������ص�����������_____�������û�ѧ����ʽ���м��㣬д�����������̣�
���𰸡�����©�� Zn+H2SO4=ZnSO4+H2�� B ���³�ѹ������������ˮ�Ҳ���ˮ��Ӧ ���������Ὣװ����ԭ�п��������ռ�װ�ã��ռ����������Ҳ�����˼�������������ʹ�ռ����������ƫ�� 81.7%
��������
��1�����ݳ�����������֪������b������Ϊ������©��������:����©��
��2��ʵ������п����ϡ���ᷴӦ��������п���������ʿ�������ȡ�������仯ѧ����ʽΪZn+H2SO4=ZnSO4+H2�������ڹ�Һ�������ͣ���ѡ��B��Ϊ����װ�á������ڳ��³�ѹ�£�����������ˮ�Ҳ���ˮ��Ӧ���ʿ���Eװ����ˮ���ռ����������Zn+H2SO4=ZnSO4+H2����B�����³�ѹ������������ˮ�Ҳ���ˮ��Ӧ
��3�����ڼ��������Ὣװ����ԭ�п��������ռ�װ�ã��ռ����������Ҳ�����˼�������������ʹ�ռ����������ƫ��3��ʵ���ռ��������������ƽ��ֵ������ֵҪ�ߡ�������������Ὣװ����ԭ�п��������ռ�װ�ã��ռ����������Ҳ�����˼�������������ʹ�ռ����������ƫ��
��4������ʵ���Ҽ�������غͶ������̵Ļ����30g��ȡ��������ȫ��Ӧ��ʣ���������Ϊ20.4g�����Լ�������ɵ�����������Ϊ30g-20.4g=9.6g���⣺��ԭ�����������ص�����Ϊx��

![]()
x=24.5g
ԭ�����������ص���������Ϊ��![]()
��ԭ�����������ص���������Ϊ81.7%�����81.7%