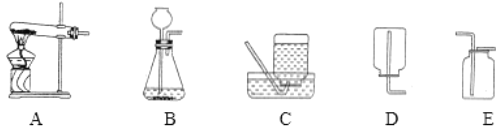
题目内容
【题目】同学们在验证氢氧化钙的化学性质时,分别取少量氢氧化钙溶液于四支试管中,做了以下实验:请根据实验回答下列问题。

(1)A中观察到的现象是_______________。
(2)写出D中发生反应的化学方程式是____________________________
(3)C中无明显现象,为证明氢氧化钙与盐酸能发生反应,他们向B中滴加稀盐酸,当观察到______时,说明两者发生了反应。
(4)实验结束后,同学们将上述四支试管中的物质倒人同一烧杯内,烧杯底部有白色固体,上层为无色溶液,此时溶液中的溶质一定有_______(除酚酞外),可能有的溶质是:____。
(5)根据氢氧化钙的化学性质,写出它的一种用途______________。
【答案】 石灰水变浑浊 Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓ 溶液由红色变成无色 NaCl CaCl2 中和酸性土壤
【解析】(1)二氧化碳气体通入澄清石灰水中的现象是石灰水变浑浊;
(2)D装置碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应方程式为Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓;
(3)氢氧化钠溶液中加入酚酞,溶液变为红色,当加入稀盐酸时,稀盐酸与氢氧化钠反应生成氯化钠,当恰好完全反应时,溶液显中性,溶液由红色变为无色;将述四支试管中的物质倒人同一烧杯内烧杯底部有白色固体,上层为无色溶液,说明溶液中一定没有碱性物质,故混合溶液中一定有氯化钠生成,白色沉淀可能是A和D中生成的碳酸钙,故一定有的物质是氯化钠,可能含有氯化钙;
(4)氢氧化钙可以改良酸性土壤;

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】甲、乙、丙、丁四位同学分别用质量分数相同的盐酸与相同质量的石灰石样品充分反应,实验测定样品中碳酸钙的质量分数。(样品中的杂质不溶于水,且不与盐酸反应),测得数据如下表:
甲同学 | 乙同学 | 丙同学 | 丁同学 | |
加入盐酸的质量(g) | 20.0 | 30.0 | 45.0 | 50.0 |
剩余固体的质量(g) | 6.0 | 4.0 | 1.0 | 1.0 |
请计算:
(1) 样品与45g盐酸充分反应后,盐酸是否还剩余 (填“是”或“否”),样品中碳酸钙的质量分数是 _。
(2) 产生二氧化碳4.4g需可多少g该样品与足量稀盐酸反应?(写出计算过程,计算结果精确到小数点后一位)