题目内容
【题目】某研究性学习小组同学在学习了酸、碱、盐的知识后,走进化学实验室。邀请你参加以下活动。
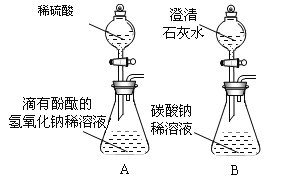
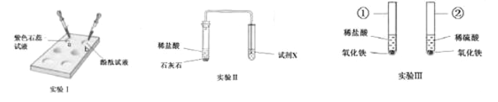
(活动一)甲、乙两同学想用实验证明稀盐酸和NaOH稀溶液确实能发生反应,设计了如图A所示的实验,并各自进行操作。
(1)甲同学根据锥形瓶内溶液由红色变成无色,得出以下两个结论:①HCl与NaOH确实发生了化学反应;②反应后得到的氯化钠溶液的pH_____7(填“≤”或“>”)。
(2)要证明HCl与NaOH确实发生了化学反应不只有上述一种方法。甲同学在老师的指导下,又设计了以下二个方案:
方案一:取适量pH=12的NaOH溶液于烧杯中,加入一定量的稀盐酸,充分搅拌。若测得所得溶液的pH为_____(填字母代号)。由此,就可以得出该反应确实发生了的结论。
A 5 B 8 C 12 D 13
方案二:已知中和反应为放热反应。取适量NaOH固体于烧杯中,加入一定量的稀盐酸,充分搅拌,测得所得溶液的温度明显升高。由此,得出该反应确实发生了结论。你认为该方案是否严谨?理由是_____。
(活动二)丙、丁两同学想再现课本上将“澄清石灰水滴入Na2CO3溶液”的实验现象,设计了如图B所示的实验,并各自进行操作。
(3)丙同学实验后,想知道反应后所得上层清液中的溶质成分。设计了如下方案:取适量上层清液于烧杯中,加入足量CaCl2溶液(中性),充分反应.,观察到有白色沉淀产生,然后过滤,向滤液中滴加几滴酚酞,滤液变红。由此,得出原上层清液中的溶质为NaOH和Na2CO3。若将上述步骤中的CaCl2溶液换成_____(填字母代号),也能通过观察现象得出同样的结论。
A BaCl2溶液(中性) B Ba(OH)2溶液 C NaCl溶液 D Ca(OH)2溶液
(活动三)乙、丁两同学在完成实验后,将两个反应后的混合物倒入一个洁净的烧杯中,充分搅拌,静置,观察到烧杯底部有白色沉淀,上层清液为无色。
(4)请写出烧杯中上层清液的溶质(酚酞除外)的可能组成:_____、_____、_____。(每根划线上写一种可能组成,可不填满,也可以加。每空2分,多写或少写都扣分。)
【答案】≤ AB 该方案不严谨,因为氢氧化钠固体溶于水放出大量的热,温度升高不能确定中和反应是否放热; ABD NaCl NaOH Na2CO3
【解析】
(1)酚酞遇碱性溶液变红,遇中性或酸性溶液不变色,锥形瓶内溶液由红色变成无色,证明溶液由碱性变中性或者酸性,反应后得到的氯化钠溶液的pH≤7;
(2)方案一:取适量pH=12的NaOH溶液于烧杯中,加入一定量的稀盐酸,充分搅拌,氢离子与氢氧根反应,消耗氢氧根,使溶液的碱性减弱即pH值变小,所以测得所得溶液的pH值小于12,即可证明HCl与NaOH确实发生了化学反应,故选AB;
方案二:该方案不严谨,因为氢氧化钠固体溶于水放出大量的热,温度升高不能确定中和反应是否放热;
(3)澄清石灰水滴入碳酸钠溶液中,生成碳酸钙沉淀和氢氧化钠,所以所得上层清液中肯定有氢氧化钠,要想得出原上层清液中的溶质为NaOH和Na2CO3的结论,只要证明上层清液中有无Na2CO3即可;
BaCl2溶液(中性)、Ba(OH)2溶液、Ca(OH)2溶液均可与碳酸钠反应生成沉淀,均可以证明碳酸钠的存在,氯化钠与碳酸钠不反应,故选ABD;
(4)乙同学实验后的溶液中肯定有氯化钠,可能含有盐酸;丁同学实验后的溶液中肯定有氢氧化钠,碳酸钠过量,溶液中有碳酸钠或石灰水过量,溶液中有氢氧化钙,也可能二者恰好完全反应,溶液中只有氢氧化钠,还有碳酸钙沉淀;
将乙、丁同学实验反应后的混合物倒入一个洁净的烧杯中,充分搅拌,静置,观察到烧杯底部有白色沉淀,证明上层清液中没有盐酸,也可能是盐酸与碳酸钙反应了,生成氯化钙和水和二氧化碳,所以烧杯中上层清液的溶质(酚酞除外)的可能组成:① NaCl、NaOH、Na2CO3;② NaCl、NaOH、CaCl2;③ NaCl、NaOH、Ca(OH)2;④NaCl、NaOH、Ca(OH)2、CaCl2;写任意一组即可。