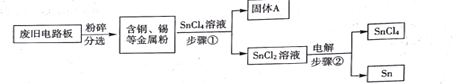
题目内容
【题目】如图是甲转化为丙的微观过程,下列说法不正确的是( )
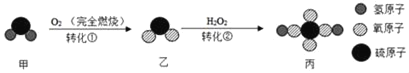
A. 转化①中甲和O2反应的分子个数比为1:1
B. 丙中硫元素的化合价是+6价
C. 转化②是化合反应
D. 反应前后原子种类不变
【答案】A
【解析】
根据反应的微观过程图,分析反应物、生成物写出反应的化学方程式,据其意义分析判断回答有关的问题。由微粒的构成和变化可知,反应①、②的方程式分别是:2H2S+3O2![]() 2SO 2+2H2O、SO 2+H2O2═H2SO4。
2SO 2+2H2O、SO 2+H2O2═H2SO4。
A、由方程式可知,反应①中甲和O2反应的分子个数比为2:3,选项A错误;
B、丙为H2SO4,硫元素的化合价为+6价,选项B正确;
C、转化②是两种物质生成一种物质,属于化合反应,选项C正确;
D、由微粒的示意图中微粒的变化可知,反应前后原子种类不变,选项D正确。
故选:A。

【题目】合成氨是人类科学技术对社会发展与进步做出了巨大贡献.合成氨的工艺流程图如图1:
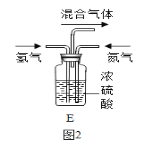
(1)空气中氮气的体积分数约为 ______ 。
(2)写出N2、H2反应生成NH3的化学方程式 ______ 。已知同温同压下,相同数目的气体分子具有相同的气体体积,理论上氢气和氮气恰好完全反应时,则氢气和氮气的体积比为 ______ ,图2装置中的浓硫酸作用除了混合气体、通过导管口的气泡控制气体的流量的作用外,还有 ______ 作用。
(3)将沸点不同的气体分离开来,常采用液化分离法。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,最适宜的温度应该控制在 ______ .。
物质 | H2 | N2 | O2 | NH3 |
沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
A -252℃≤t<-33.5℃ B -252℃≤t<-195.8℃ C -195.8℃≤t<-33.5℃
(4)该工艺流程中能循环利用的物质是 ______ 。
(5)实验室常用加热硫酸铵和熟石灰的固体混合物来制取氨气,写出该反应的化学方程式
______ ,实验室制取该气体的发生装置应选择下列装置中的 ______ (填字母代号),
用D装置收集氨气时,证明氨气集满常用 ______ 试纸放在 ______ 导管口(填“a”或“b”)
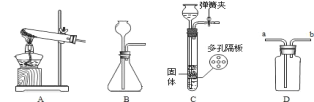
(6)实验室制取二氧化碳时发生反应的化学方程式 ______ ,上述装置中可用于制取二氧化碳气体发生装置的是 ______ (填字母代号)
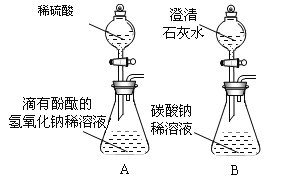
【题目】小华同学无意将NaOH溶液与NaHCO3溶液混合,发现无明显现象。对此他产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他进行了以下探究。

(查阅资料)NaHCO3溶液能与NaOH溶液反应生成一种新盐和一种常见的液体氧化物。
NaHCO3在50℃开始分解。
(实验探究)用一定溶质的质量分数的NaHCO3、NaOH和Na2CO3三种溶液进行如下实验,为设计实验方案提供参考。
NaHCO3溶液 | NaOH溶液 | Na2CO3溶液 | |
加入稀盐酸 | 现象Ⅰ | 无明显变化 | 产生气泡 |
加入澄清石灰水 | 溶液变浑浊 | 无明显变化 | 现象Ⅱ |
加入CaCl2稀溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
加热溶液至沸腾,将 气体通入澄清石灰水 | 澄清石灰水 变浑浊 | 澄清石灰水 无明显变化 | 澄清石灰水 无明显变化 |
(1)表中的现象Ⅰ为_____,发生现象Ⅱ对应反应的化学方程式为_____。
实验过程
(实验探究)证明反应生成了新盐
(2)NaHCO3溶液能与NaOH溶液反应生成新的盐是_____(填物质名称)。同学们选用上表实验中的药品,设计了如图所示实验,先在NaHCO3 溶液中加入A溶液,无明显现象,再滴加NaOH溶液,溶液变浑浊,则A溶液是_____。
(3)有同学提出上述实验方案有问题,其理由是_____。为了达到实验目的,你需要继续进行的操作是_____。
(交流反思)证明反应后NaHCO3不存在
(4)同学们参考上表中的实验,又设计了一个实验,虽然没有观察到明显的实验现象,但可以证明反应发生了,你的实验方案是_____。