题目内容
【题目】用如图所示的装置进行电解水实验,有以下描述:①该实验可以证明水是由氢元素与氧元素组成的 ②甲、乙两试管内收集到的气体的体积比约为2:1 ③乙试管内产生的气体能燃烧 ④甲试管内产生的气体能使带火星的木条复燃。以上描述中正确的是
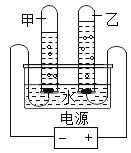
A.①②③④B.③C.①②D.①②③
【答案】C
【解析】
电解水生成氢气和氧气两种气体,说明水是由氢、氧元素组成的;电解水生成负极生成氢气和正极氧气的体积比是2:1。
①电解水生成氢气和氧气两种气体,该实验可以证明水是由氢元素与氧元素组成的,故正确;
②电解水生成负极生成氢气和正极氧气的体积比是2:1,则甲、乙两试管内收集到的气体的体积比约为2:1,故正确;
③乙试管和正极相连,生成的气体为氧气,则产生的气体不能燃烧,故不正确;
④甲试管和负极相连,生成的气体为氢气,则产生的气体能燃烧,不能使带火星的木条复燃,故不正确。
故正确的是①②,选C。

练习册系列答案
相关题目