题目内容
为测定锌铜合金中锌的含量,取该合金放入如图 14 盛有稀硫酸的锥形瓶中,发生反应: Zn+H2SO4=ZnSO4+H2↑ 。多次实验后,取平均值所得数据如下表:

若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量。
(2)该合金中锌的质量分数。

| 反应前 | 充分反应后装置及反应剩余物质质量 | |
| 装置和足量的稀硫酸质量 | 锌铜合金质量 | |
| 342.10g | 16.00g | 357.70g |
若不考虑干燥剂吸收空气中的水蒸气,计算:
(1)根据质量守恒定律求生成氢气的质量。
(2)该合金中锌的质量分数。
(1)0.4g (2)81.25%
有关化学方程式的就是按照有关化学方程式的简单计算的步骤:(1)设未知数(2)依据题意写方程式(3)写出相关量(4)列比例式求解(5)简单写出答案。该题中合金总共为16g ,但只有Zn和稀硫酸发生反应,通过反应前后质量的变化求出H2的质量,在通过H2的质量求出Zn的质量,进一步就出Zn的质量分数。
解:依题意可得
(1)氢气的质量=342.10g+16.00g-357.70g=0.4g
答:氢气的质量为0.4g
(2)解:设该合金中锌的质量为xg
Zn + H2SO4=ZnSO4+H2↑
65 2
x 0.4g
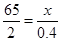
x=13g
答:该合金中锌的质量分数为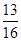
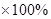 =81.25%
=81.25%
解:依题意可得
(1)氢气的质量=342.10g+16.00g-357.70g=0.4g
答:氢气的质量为0.4g
(2)解:设该合金中锌的质量为xg
Zn + H2SO4=ZnSO4+H2↑
65 2
x 0.4g
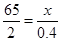
x=13g
答:该合金中锌的质量分数为
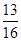
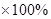 =81.25%
=81.25%
练习册系列答案
相关题目