题目内容
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体。某化学兴趣小组对蓝色固体的成分进行了定性探究,得知其为Cu(OH)2和CuCO3的混合物。
(1)蓝色固体中含有CuCO3,原因是: (用化学方程式表示);蓝色固体中含有Cu(OH)2,原因是:Na2CO3溶液呈 性(选填“酸”、“中”或“碱”)。
(2)已知:Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,且各生成对应的两种氧化物。设蓝色固体的组成为aCu(OH)2?bCuCO3,该小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如右图。
①写出CD段发生反应的化学方程式:
。
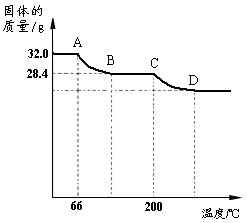
②根据右图计算出a︰b的值。(写出计算过程,计算结果用最简整数比表示)
③D点对应纵坐标的值为 。
(1)蓝色固体中含有CuCO3,原因是: (用化学方程式表示);蓝色固体中含有Cu(OH)2,原因是:Na2CO3溶液呈 性(选填“酸”、“中”或“碱”)。
(2)已知:Cu(OH)2的分解温度为66℃~68℃,CuCO3的分解温度为200℃~220℃,且各生成对应的两种氧化物。设蓝色固体的组成为aCu(OH)2?bCuCO3,该小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如右图。
①写出CD段发生反应的化学方程式:
。

②根据右图计算出a︰b的值。(写出计算过程,计算结果用最简整数比表示)
③D点对应纵坐标的值为 。
(1)CuSO4+ Na2CO3 CuCO3↓ + Na2SO4 碱;(2)①CuCO3 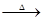 CuO+CO2↑,②a:b=2:1;③
CuO+CO2↑,②a:b=2:1;③
 CuO+CO2↑,②a:b=2:1;③
CuO+CO2↑,②a:b=2:1;③试题分析:(1)CuSO4+ Na2CO3 CuCO3↓ + Na2SO4 Na2CO3溶液呈碱性,和硫酸铜反应生成氢氧化铜;
(2)①CuCO3
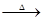 CuO+CO2↑
CuO+CO2↑②解:根据图像,可得AB段是Cu(OH)2受热分解,生成的水的质量为32.0g-28.4g =3.6g
设生成3.6g水所需的Cu(OH)2的质量为
 。
。Cu(OH)2
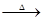 CuO+H2O
CuO+H2O98 18
 3.6g
3.6g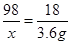
 = 19.6g
= 19.6g所以CuCO3的质量为32.0g-19.6g =12.4g
根据蓝色固体组成可得
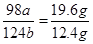
得a:b=2:1
③由图和前面的计算可知,物质的化学式为2Cu(OH)2?CuCO3,且开始时为32g,D点只有氧化铜,根据铜元素质量守恒可得氧化铜的质量为
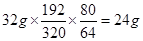 .
.点评:这是化学反应联系方程式的计算题,这种题目是每年中考的压轴题,必考题,这类题目的难点在于理顺题目中的已知条件。

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目