题目内容
味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl(其他成分不考虑).某兴趣小组配制味精溶液并测定NaCl质量分数,请回答下列问题:
(1)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是______(填字母).
A.10mL B.50mL C.100mL
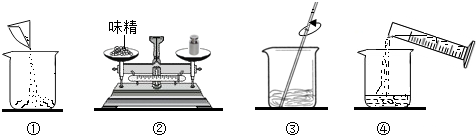
(2)如图是配制过程,正确的操作顺序为______→______→______→______(填序号).
(3)为测定味精中NaCl的质量分数,进行如下实验:向所配制的50g溶液中加入过量的AgNO3溶液充分反应.检验沉淀是否完全的方法是:静置后,在上层清液中加入______溶液(填化学式),观察是否有沉淀生成.过滤后,洗涤、干燥、称量沉淀并计算.
(4)计算后发现NaCl的质量分数偏低,则可能的原因是______(填字母).
A.配溶液时仰视量水 B.过滤时待滤液面高于滤纸边缘 C.洗涤、干燥沉淀不彻底.
解:(1)取5.0g味精配制成50g溶液,则需要水的质量50g-5.0g=45g,45g水合45mL,因此需要选择50mL的量筒.故选B;
(2)图①为称量完毕的味精倒入烧杯,图②为称量味精的质量,图③为进行溶解,图④为量取水后倒入盛有味精的烧杯,因此,正确的操作顺序为②①④③,故答案为:②①④③
(3)氯化钠与硝酸银溶液能发生化学反应,生成白色沉淀,反应化学方程式为AgNO3+NaCl═AgCl↓+NaNO3;向清液中再滴加硝酸银溶液,若观察到无明显现象说明原来已经完全沉淀.故答案为:AgNO3
(4)A、用量筒量取水时仰视读数,则会使量取的液体偏大,从而使溶质的质量分数减小,故A可能;
B、过滤时滤液面高于滤纸边缘会导致测得的氯化银质量减小,从而导致计算出的溶质氯化钠减小,从而使溶质的质量分数减小,故B可能;
C、洗涤、干燥沉淀不彻底会导致测得的氯化银质量增大,从而导致计算出的溶质氯化钠增大,从而使溶质的质量分数增大,故B不可能.
故选AB.
分析:(1)根据溶液质量=溶质质量+溶剂质量,由5.0g味精配制成50g溶液,求出配制时所需水的量,然后选择量取蒸馏水的量筒;
(2)根据使用固体物质配制溶液的步骤:计算、称量、溶解,判断实验操作图中操作的顺序;
(3)溶液中的氯化钠与硝酸银溶液能发生化学反应,生成白色沉淀;可采取再滴加硝酸银溶液的方法,观察是否有沉淀,若无沉淀说明已经沉淀完全;
(4)根据溶质的质量分数的计算公式可以知道,若质量分数偏小,则溶质少了,或是溶剂多了.可以据此解答.
点评:掌握溶解、过滤、蒸发等实验的操作技能;理解过滤法分离混合物的原理;体会过滤的原理在生活生产等社会实际中的应用.本题具有较大的综合性,在解答时需要涉及较多的基础知识,因此,需要足够的耐心和毅力
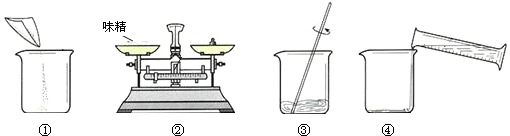
(2)图①为称量完毕的味精倒入烧杯,图②为称量味精的质量,图③为进行溶解,图④为量取水后倒入盛有味精的烧杯,因此,正确的操作顺序为②①④③,故答案为:②①④③
(3)氯化钠与硝酸银溶液能发生化学反应,生成白色沉淀,反应化学方程式为AgNO3+NaCl═AgCl↓+NaNO3;向清液中再滴加硝酸银溶液,若观察到无明显现象说明原来已经完全沉淀.故答案为:AgNO3
(4)A、用量筒量取水时仰视读数,则会使量取的液体偏大,从而使溶质的质量分数减小,故A可能;
B、过滤时滤液面高于滤纸边缘会导致测得的氯化银质量减小,从而导致计算出的溶质氯化钠减小,从而使溶质的质量分数减小,故B可能;
C、洗涤、干燥沉淀不彻底会导致测得的氯化银质量增大,从而导致计算出的溶质氯化钠增大,从而使溶质的质量分数增大,故B不可能.
故选AB.
分析:(1)根据溶液质量=溶质质量+溶剂质量,由5.0g味精配制成50g溶液,求出配制时所需水的量,然后选择量取蒸馏水的量筒;
(2)根据使用固体物质配制溶液的步骤:计算、称量、溶解,判断实验操作图中操作的顺序;
(3)溶液中的氯化钠与硝酸银溶液能发生化学反应,生成白色沉淀;可采取再滴加硝酸银溶液的方法,观察是否有沉淀,若无沉淀说明已经沉淀完全;
(4)根据溶质的质量分数的计算公式可以知道,若质量分数偏小,则溶质少了,或是溶剂多了.可以据此解答.
点评:掌握溶解、过滤、蒸发等实验的操作技能;理解过滤法分离混合物的原理;体会过滤的原理在生活生产等社会实际中的应用.本题具有较大的综合性,在解答时需要涉及较多的基础知识,因此,需要足够的耐心和毅力

练习册系列答案
相关题目
 味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na).某品牌味精包装上标注内容如图所示,请回答:
味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na).某品牌味精包装上标注内容如图所示,请回答: