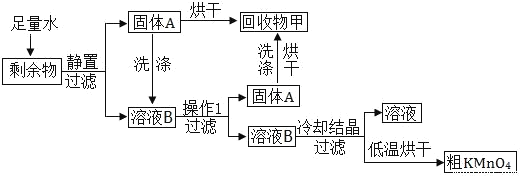
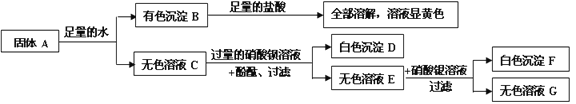
��Ŀ����
����Ŀ����֪2Na2O2 + 2CO2 = 2Na2CO3 + O2��2Na2O2 + 2H2O = 4NaOH + O2����a g̼��Ԫ��������Ϊ6:1��CO��H2�Ļ����������������ȫȼ�գ�����ȼ�ղ���ͨ�������Na2O2���壬����˵����ȷ���ǣ�������
A.��Ӧ��Ĺ�����Na2CO3�� NaOH��������Ϊ53:20
B.��Ӧ��Ĺ�������Ԫ�ص�����������С
C.ȡ������Ӧ��Ĺ������Թ��У���������ϡ���������ݲ��������֤����������Na2CO3
D.��Ӧ���������������a g
���𰸡�D
��������
��a g̼��Ԫ��������Ϊ6:1��CO��H2�Ļ����������������ȫȼ�գ����ݷ�Ӧ����2CO+O2![]() 2CO2 ��2H2+O2
2CO2 ��2H2+O2![]() 2H2O��CO��H2��������Ϊ6:1�����Ӧ��CO2��H2O��������Ϊ22:21������
2H2O��CO��H2��������Ϊ6:1�����Ӧ��CO2��H2O��������Ϊ22:21������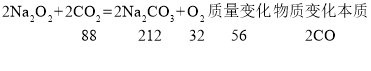 ��
�� ��
��
A�����ݷ�����Ӧ��Ĺ�����Na2CO3�� NaOH��������Ϊ53: ![]() =159:280����ѡ�����
=159:280����ѡ�����
B����Ӧ��Ĺ�������Ԫ�ص��������������Ϊһ����̼�е���Ԫ�ؽ��뵫̼�����У���ѡ�����
C��ȡ������Ӧ��Ĺ������Թ��У���������ϡ���������ݲ���������֤����������Na2CO3��Ϊ�������ƺ�ϡ���ᷴӦ������������������ѡ�����
D������������Ϊ��Ӧ��һ����̼����������������ѡ����ȷ����ѡD��