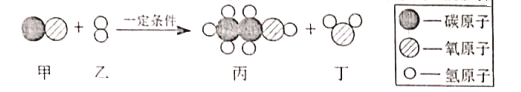
题目内容
【题目】A~I都是初中化学中的常见物质,且有如图所示转化关系(部分反应物、生成物及反应条件均已略去)。已知A为金属单质,其它均为化合物。F为大理石的主要成分,E为一种常见的不挥发性酸。
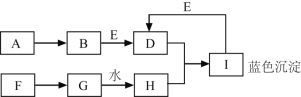
回答下列问题:
(1)写出下列物质的化学式:B ________。
(2)写出反应的化学方程式:①D溶液+H溶液:________;②F→G:_____________。
【答案】CuO; CuSO4+Ca(OH)2====Cu(OH)2↓+CaSO4 CaCO3![]() CaO+CO2↑
CaO+CO2↑
【解析】
F为大理石的主要成分,则F是碳酸钙,F生成的G能与水反应生成H,碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙,G可能是氧化钙,H可能是氢氧化钙;H能与D反应生成蓝色沉淀I,蓝色沉淀是氢氧化铜,E为一种常见的不挥发性酸,则E可能是是稀硫酸,能与氢氧化铜反应生成D硫酸铜,故B中含有铜元素,A为金属单质,则A为铜,A能生成B,铜与氧气反应生成氧化铜,B为氧化铜,氧化铜与硫酸反应生成硫酸铜和水,氢氧化钙与硫酸铜反应生成氢氧化铜和硫酸钙。将猜想代入框图,推断合理。
根据以上分析可知:
(1)B为氧化铜,化学式为:CuO;
(2)①D溶液+H溶液的反应是硫酸铜能与氢氧化钙反应生成氢氧化铜沉淀和硫酸钙,反应的化学方程式为:CuSO4+Ca(OH)2=Cu(OH)2↓+CaSO4;
②F→G 的反应是碳酸钙高温分解生成氧化钙和水,反应的化学方程式为CaCO3![]() CaO+CO2↑。
CaO+CO2↑。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】兴趣小组借助如图装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。

(1)实验前用砂纸打磨铁钉至光亮的目的是_____。
(2)已知试管剩余空间和导管的体积为20mL,导管截面积约为1cm2,充分反应后,形成稳定液柱时,读取读数为4.1cm,则空气中氧气的体积分数为_____%(保留小数点后一位)。
(3)实验时发现上述测量过程因反应较慢耗时较长,现对影响铁生锈速率的因素作如下
(提出假设)假设一:溶液的酸碱度;
假设二:NaC1溶液的浓度;
请你再提出一种影响铁生锈快慢的因素。
假设三:_____。
(实验探究)借助上述实验装置,通过控制铁钉用量等其他条件均相同时,调节溶液的pH获得了如表实验数据:
pH | 2.0 | 5.5 | 6.0 | 6.5 | 7.0 | 8.0 |
液柱高度(cm) | 0 | 0.6 | 4.1 | 4.1 | 4.1 | 4.1 |
形成稳定液柱时间(min) | 3.0 | 3.0 | 5.1 | 5.3 | 15.6 | 17.5 |
(实验结论)根据实验数据分析,为缩短实验测定时间,pH的最佳范围是_____;还可以采取何种方法进一步缩短实验时间_____(答一条即可)。
(实验反思)当pH=2时,没有观察到稳定液柱形成的原因是_____。