题目内容
【题目】(19分)实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
【提出问题1】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:全部是NaOH 猜想Ⅱ:已完全变质,该样品中只含Na2CO3;
猜想Ⅲ:部分变质,该样品中含有 ① 。
【查阅资料】 CO2在饱和碳酸氢钠溶液中几乎不溶解。
【实验探究1】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
1)取少量样品溶于水,加入 ② | 白色沉淀产生 | 该反应的化学方程式:③ 氢氧化钠已经变质 |
2)将上述反应后的混合物过滤,取滤液加入 ④ | ⑤ | 证明猜想Ⅲ正确 |
回答下列问题
(1)实验室中,氢氧化钠固体应怎样保存? ⑥
(2)用酚酞试液 ⑦ (填“能”或“不能”)检验氢氧化钠变质。
(3)若取少量的固体溶于水, 滴加几滴稀盐酸,没有气泡产生。__⑧ ___(填“能”或“不能”)证明氢氧化钠固体没有变质。
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
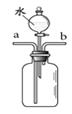
【实验探究2】小红同学设计如图所示装置(铁架台略去),实验在20℃,101kPa下进行,步骤如下:

①按图连接好装置;
②检查装置气密性
③用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
④向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和碳酸氢钠溶液224mL。
请回答下列问题:
(1)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由 ⑨
(2)试管中原有的空气对实验结果没有明显影响理由是 ⑩
(3)变质氢氧化钠样品中碳酸钠的质量分数为 (20℃,101kPa下,22.4L二氧化碳的质量为44g)
【拓展提高】已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2。现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液。请分析推断反应后所得X溶液的溶质,其所有的可能组成Na2SO4和NaHCO3、 、 。
【答案】①NaOH和Na2CO3②过量的CaCl2溶液 ③ CaCl2 +Na2CO3= 2NaCl + CaCO3 ↓④ 酚酞溶液
⑤ 变红 ⑥ 密封保存 ⑦ 不能 ⑧ 不能 ⑨ 避免CO2溶解在水中有损耗,导致测定结果偏低;
⑩ 因为试管中原有空气的体积与反应后试管中没有排尽的二氧化碳的体积几乎等同
53% Na2SO4 ,Na2SO4 H2SO4
【解析】
试题分析:氢氧化钠固体样品如果是部分变质,该样品中含有NaOH和Na2CO3,现象中出现沉淀说明加入的物质是过量的CaCl2溶液,将上述反应后的混合物过滤,取滤液加入酚酞溶液,如果变红证明猜想Ⅲ正确,碳酸钠的溶液PH值大于7,所以不能用来检验是否变质,用盐酸不能检验碳酸钠的存在,因为加入的盐酸首先会和氢氧化钠反应,B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由避免CO2溶解在水中有损耗,导致测定结果偏低,试管中原有的空气对实验结果没有明显影响理由是因为试管中原有空气的体积与反应后试管中没有排尽的二氧化碳的体积几乎相等,224mL二氧化碳的质量是0.44克,根据化学方程式可以计算得到必须要1.06克的碳酸钠,所以变质氢氧化钠样品中碳酸钠的质量分数为=1.06/2×100%=53%,硫酸的量如果不足是组成会是Na2SO4和NaHCO3,如果二者恰好反应组成会是Na2SO4,如果过量会是Na2SO4 H2SO4。

 名校课堂系列答案
名校课堂系列答案