题目内容
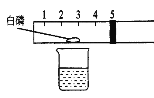
【题目】某同学在实验室发现一瓶标签残缺的硫酸铜溶液。为了测定此溶液的溶质质量分数,他取50 g该溶液,逐滴加入NaOH溶液,加入NaOH溶液的质量与生成沉淀的质量之间的关系如图所示,请回答下列问题:

(1)生成Cu(OH)2的质量为__________g。
(2)计算该硫酸铜溶液的溶质质量分数(请写出计算过程)。_______
(3)在实验过程中,以下说法正确的是________(填字母序号)。
A.0至b段溶液中溶质质量逐渐增加
B.a、b、c点对应的溶液中溶质均为一种
C.向c点对应的溶液中滴加酚酞溶液,溶液变红
D.整个过程中,溶液中氢元素的质量一直在增加
【答案】4.9解: 设该硫酸铜溶液中硫酸铜的质量为x
CuSO4+2NaOH===Cu(OH)2↓+Na2SO4
160 98
x 4.9 g
![]() =
= ![]()
X=8 g
该硫酸铜溶液的溶质质量分数为![]() ×100%=16%
×100%=16%
答:该硫酸铜溶液的溶质质量分数为16%。CD
【解析】
(1)硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,由图中数据可知,Cu(OH)2质量为4.9g;(2)由硫酸铜和氢氧化钠的反应方程式可以找出硫酸铜和氢氧化铜沉淀的质量关系,然后由氢氧化铜的质量即可求出硫酸铜的质量。设硫酸铜质量为x,
CuSO4+2NaOH=Na2SO4+ Cu(OH)2↓
160 98
x 4.9g
![]() x=8g
x=8g
硫酸铜溶液溶质质量分数为: 8g÷50g×100%=16%,
答:硫酸铜溶液溶质质量分数为16%.
(3)A、由CuSO4+2NaOH=Na2SO4+Cu(OH)2↓,
160 142
可知,当有160份质量的硫酸铜反应时生成142份质量的硫酸钠,因此随着反应的进行,0至b段溶液中溶质质量逐渐减小,该选项说法不正确;B、a点对应的溶液中溶质是硫酸铜和硫酸钠,b点对应的溶液中溶质是硫酸钠,c点对应的溶液中溶质是氢氧化钠和硫酸钠,该选项说法不正确;C、c点时溶液中含有氢氧化钠,氢氧化钠溶液显碱性,能使酚酞试液变红色,因此向c点对应的溶液中滴加酚酞溶液,溶液变红,该选项说法正确;D、硫酸铜和氢氧化钠反应时,氢氧化钠中的氢元素转化成氢氧化铜沉淀中的氢元素,而溶剂水中的氢元素进入溶液,b~c过程中,氢氧化钠溶液中的氢元素全部进入溶液,因此整个过程中,溶液中氢元素的质量一直在增加,该选项说法正确。故选CD。

 阅读快车系列答案
阅读快车系列答案【题目】小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度 |
① | 氯酸钾 | 580℃ |
② | 氯酸钾、二氧化锰(质量比1:1) | 350℃ |
③ | 氯酸钾、氧化铜(质量比l:1) | 370℃ |
④ | 氯酸钾、氧化铁(质量比1:1) | 390℃ |
(分析数据、得出结论)
(1)由实验__________与实验④对比,证明猜想合理;
(2)实验所用的三种二氧化锰、氧化铜、氧化铁,催化效果最好的是_________________。
(3)若氧化铁是该反应的催化剂,请写出这个反应的文字表达式______________。
(4)如表是二氧化锰用量与一定质量氯酸钾制取氧气反应速率关系的实验数据。
二氧化锰与氯酸钾的质量比 | 1:40 | 1:20 | 1:10 | 1:5 | 1:3 | 1:2 |
生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 |
①据如表可知二氧化锰与氯酸钾的质量比为_______________时,反应速率最快;
②通过分析可知,在化学反应中催化剂的用量____________越多越好。(填“是”或“不是”)
③二氧化锰用量过多冲淡了氯酸钾粉末,相当于减少反应物的________,所以反应速率受到影响。