题目内容
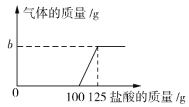
【题目】侯氏制碱法是近代中国化学家侯德榜先生的杰出发明。其生产出的碳酸钠中常含有少量的氯化钠。现有碳酸钠和氯化钠的混合物样品 12.4 g,将其放入干净的烧杯中,加入 100 g 水,使其完全溶解。向所得溶液中加入溶质质量分数为 7.3%的稀盐酸,烧杯中溶液的质量与加入稀盐酸的质量关系曲线如图所示。请回答下列问题。
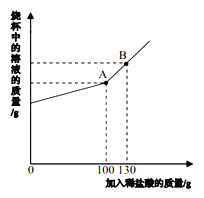
(1)B 点时,烧杯中溶液里存在的阳离子为_____、______(填写离子符号)。
(2)求原混合物样品中,含碳酸钠的质量是__________?(结果精确至 0.1 g)
(3)求A 点时,产生气体的质量为_____________g;此时所得不饱和溶液中溶质质量分数为_________(计算结果精确至0.1%)。
【答案】Na+ H+ 10.6g 4.4g 6.5%
【解析】
根据曲线可以看出加入100g稀盐酸时恰好完全反应,即A点恰好完全反应,所以B点是盐酸过量,所含溶质为生成的氯化钠以及剩余的盐酸,对应的阳离子为:Na+、H+。
消耗的HCl的质量为100g×7.3%=7.3g
设碳酸钠的质量为x,生成的氯化钠的质量为y,二氧化碳的质量为z
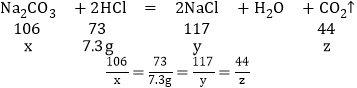
x=10.6g
y=11.7g
z=4.4g
此时所得不饱和溶液中溶质质量分数为![]() ×100%=12.5%
×100%=12.5%
故答案为:
(1)Na+、H+。
(2)10.6g。
(3)4.4; 12.5%。

【题目】在实验室中化学兴趣小组的同学发现了一瓶敞口放置的Ca(OH)2粉末状试剂。他们对该试剂进行了定量实验称取试剂19.8 g放入锥形瓶中,加入30.2 g的水,充分振荡,再向锥形瓶中依次滴加25 g盐酸充分反应。测得部分数据与图像如下。请根据有关信息回答问题。
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 | |
加入盐酸的质量/g | 25 | 25 | 25 | 25 | 25 | 25 |
锥形瓶中物质的质量/g | 75 | 100 | a | 150 | 172.8 | 197.8 |
(1)a的数值为__________,兴趣小组的同学通过实验,得出该试剂已部分变质的结论,其依据是(通过实验数据和图像写出你的分析) _______________________________。
(2)b的数值为____________。
(3)计算该试剂中氢氧化钙的质量分数___________(写出计算过程,结果保留一位小数)。