题目内容
用锌片与稀硫酸反应制H次数 加入锌片的质量 稀硫酸 产生H2质量
1 6.5g 100g 0.2g
2 13g 100g
3 19.5g 100g 0.6g
4 26g 100g 0.8g
5 32.5g 100g
6 39g 100g 0.8g
(1)第二、五次产生的氢气质量是多少?
(2)35g锌片与100g这种稀硫酸充分反应后,所得溶液的溶质质量分数为多少?
(3)稀硫酸的溶质质量分数为多少?
解析:
| (1)0.4g 0.8g
根据表分析,35g锌片与100g稀硫酸充分反应后,锌有剩余,硫酸完全反应,这时产生的H 解:设反应的锌的质量为x,硫酸的质量为y。 Zn+H 65 98 2 xy 0.8g
ZnSO4的质量为:26g+39.2g-0.8g=64.4g 所得溶液的溶质质量分数为: 稀硫酸溶液的溶质质量分数为: 答:(2)所得溶液的溶质质量分数为51.4%。 (3)稀硫酸的溶质质量分数为39.2%。
|
提示:

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案|
次数 |
加入锌片的质量 |
稀硫酸 |
产生H2质量 |
|
1 |
6.5 g |
100 g |
0.2 g |
|
2 |
13 g |
100 g |
|
|
3 |
19.5 g |
100 g |
0.6 g |
|
4 |
26 g |
100 g |
0.8 g |
|
5 |
32.5 g |
100 g |
|
|
6 |
39 g |
100 g |
0.8 g |
(1)第二、五次产生的氢气质量是多少?
(2)35 g锌片与100 g这种稀硫酸充分反应后,所得溶液的溶质质量分数为多少?
(3)稀硫酸的溶质质量分数为多少?

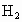 ,完全反应后,所需时间与当地金属价格见表.你认为实验室一般不选用铁屑、镁片与酸反应制氢气的主要原因是什么?
,完全反应后,所需时间与当地金属价格见表.你认为实验室一般不选用铁屑、镁片与酸反应制氢气的主要原因是什么?

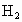 ,完全反应后,所需时间与当地金属价格见表.你认为实验室一般不选用铁屑、镁片与酸反应制氢气的主要原因是什么?
,完全反应后,所需时间与当地金属价格见表.你认为实验室一般不选用铁屑、镁片与酸反应制氢气的主要原因是什么?
