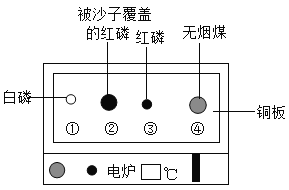
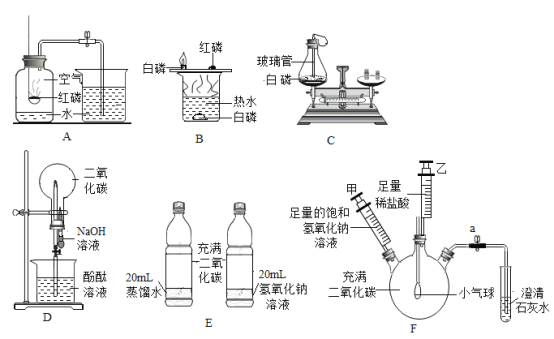
题目内容
【题目】石英的主要成分为二氧化硅,它是玻璃工业和陶究工业的原料,冶金工业的助熔剂。硅是太阳能电池和电脑芯片不可缺少的材料。生产高纯硅的流程示意困如下:

(1)制备粗硅的化学方程式为: ,则x的化学式为_____。
,则x的化学式为_____。
(2)整个制备过程必须达到无水无氧。若在H2还原SiHCl3,过程中混入O2,可能引起的后果是_____。
(3)为了达到绿色化学和节约资源的目的。物质A需要循环使用,A的化学式是_____。
【答案】CO 爆炸(硅被氧化) HCl
【解析】
(1)制备粗硅的化学方程式为: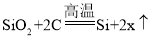 ,该反应符合质量守恒定律,反应前后各元素的原子个数不变,生成物比反应物少2个碳原子、2个氧原子,则x的化学式为:CO;
,该反应符合质量守恒定律,反应前后各元素的原子个数不变,生成物比反应物少2个碳原子、2个氧原子,则x的化学式为:CO;
(2)整个制备过程必须达到无水无氧。若在H2还原SiHCl3,过程中混入O2,氢气具有可燃性,氧气具有助燃性,在有限空间内,加热可能引起的后果是爆炸(或硅被氧化);
(3)为了达到绿色化学和节约资源的目的。三氯氢硅与氢气在高温条件反应产生硅和氯化氢的反应原理:SiHCl3+H2![]() Si+3HCl;物质A需要循环使用,A的化学式是:HCl。
Si+3HCl;物质A需要循环使用,A的化学式是:HCl。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案【题目】人类的生产生活离不开金属材料
(1)人类历史上金属大规模开发、利用的先后顺序与多种因素有关,请列举一条相关的因素_____。
(2)下表示一些金属的熔点数据:
金属 | 铅 | 锡 |
熔点/℃ | 327.5 | 231.9 |
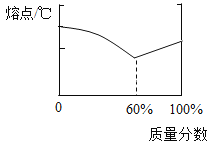
锡铅合金中某种金属的质量分数与合金熔点有如图所示的关系。当合金熔点最低时,合金中锡与铅的质量比是_____。
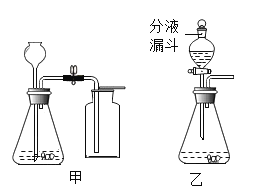
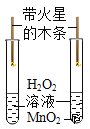
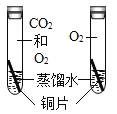
(3)如下图所示,为实验室中常见的气体制取和收集装置:
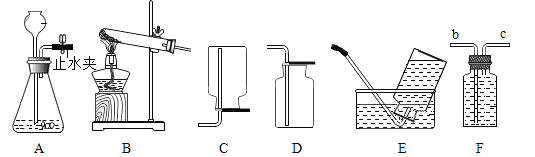
①检查A装置气密性的方法是夹紧止水夹,_____,则气密性良好。
②实验室用金属锌和稀硫酸可以制取氢气,如果想得到较干燥的氢气,可选用的一套制取装置为_____,反应的化学方程式为_____。若采用F装置来收集氢气,氢气应从_____通入(选填b或c)。
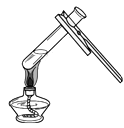
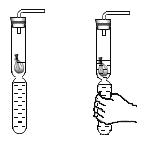
③课外小实验中,小明同学利用废弃的“棒棒冰”塑料为材料制成了如图所示的气体发生装置。该装置与A装置相比的优点有哪些_____(写出一点即可)
(4)某兴趣小组利用废铁屑与废硫酸起反应来制取硫酸亚铁(只考虑铁与酸的反应)他们将6g废铁屑放入烧杯中,缓慢加入废硫酸直至不再产生气泡。发现加入废硫酸的质量为98g,最后称得称量烧杯的总质量为103.8g(不含烧杯的质量)。试求制取硫酸亚铁的质量为多少_____?