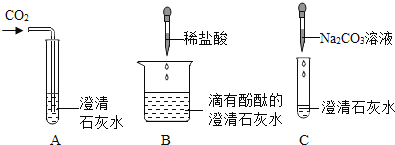
题目内容
【题目】一瓶氢氧化钠固体,因不慎敞口放置了一段时间,已经部分变质。某化学课外兴趣小组的同学决定测定该瓶氢氧化钠变质的程度。
(1)请写出氢氧化钠在空气中变质的化学方程式_______________;
(2)测定步骤
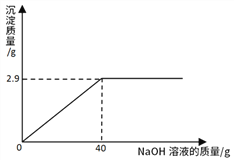
第一步:取该瓶中的氢氧化钠固体样品10g加水配制成溶液;
第二步:向上述溶液中加入足量的澄清石灰水;
第三步:过滤、干燥、称重,生成沉淀为1g。
请计算该10g氢氧化钠固体中含有杂质Na2CO3的质量分数_________。
【答案】 2NaOH + CO2 = Na2CO3 + H2O 10.6%。
【解析】(1)氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水;(2)由生成沉淀碳酸钙的质量计算样品中碳酸钠的质量,该质量与样品的质量比可计算含有杂质Na2CO3的质量分数。(1)氢氧化钠在空气中变质的化学方程式为2NaOH+CO2=Na2CO3+H2O;(2)设碳酸钠的质量为x。
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 1g![]()
x=1.06g
该10g氢氧化钠固体中含有杂质Na2CO3的质量分数=![]() ×100%=10.6%
×100%=10.6%
答:10g氢氧化钠固体中含有杂质Na2CO3的质量分数10.6%。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中然烧的实验(如图1)。
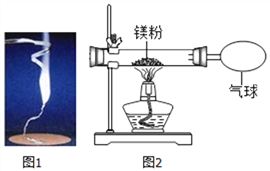
同学们观察到镁条在空气中剧烈燃烧,发出耀眼的白光,因此镁在军事上作_________;
同时同学们还观察到产生的大量白烟弥漫到空气中,最后一些白色固体掉落在仪器A上。
(1)上述仪器A名称是____________。
(2)同学们通过称量发现:在仪器A上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:____________。
(3)小红按下图2装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁( Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
实验操作 | 实验现象及结论 |
_______________________ | ________________ |
【反思与交流】
①写出镁条燃烧生成氮化镁的化学方程式为____________________;
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_________________;
③同学们又联想到氢气在氯气中能够燃烧,于是对燃烧条件又有了新的认识:___________