题目内容
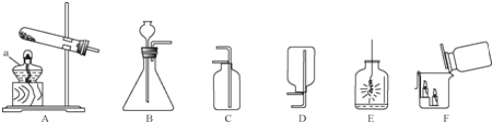
【题目】某种碳酸盐类铜矿的化学式可表示为aCuCO3bCu(OH)2。已知Cu(OH)2和CuCO3受热都能分解,分别生成两种常见的氧化物。某兴趣小组的同学对其组成做了一些探究。小组同学称取了样品17.3g,用下图装置进行了实验。
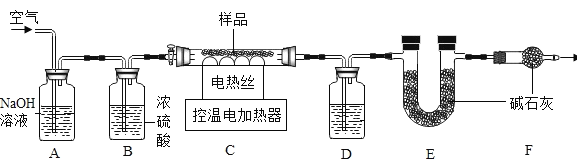
(1)请写出一种你所熟悉的碳酸盐类铜矿的名称_____。
(2)请写出A中发生化学反应的化学方程式_____。
(3)D装置中试剂的作用是_____,实验过程中持续通入空气的目的是_____,C装置中的现象_____。
(4)对样品进行热分解,直至C装置中剩余固体质量不再变化为止,再缓缓通入一段时间空气。冷却后测得装置D增重0.9g,装置E增重4.4g.通过计算可得a∶b=_____。若缺少B装置,测得的a∶b的值会_____。(选填“偏大”、“偏小”、“不变”)
(5)此实验对温度控制要求较高。若温度控制不当,会发现反应后的固体物质中有少量红色物质出现。有的同学认为这一定是生成了铜,你同意他的观点吗?_____(选填“同意”或“不同意”),理由是_____。
【答案】孔雀石 CO2+2NaOH=Na2CO3+H2O 吸收水蒸气 使反应生成的水蒸气、二氧化碳被D、E装置充分吸收 样品变黑色 2:1 偏小 不同意 氧化亚铜也是红色固体
【解析】
(1)碳酸盐类铜矿有孔雀石、石青等。
(2)A中二氧化碳和氢氧化钠反应生成碳酸钠和水,发生化学反应的化学方程式为:CO2+2NaOH=Na2CO3+H2O。
(3)D装置中试剂的作用是吸收水蒸气,实验过程中持续通入空气的目的是使反应生成的水蒸气、二氧化碳被D、E装置充分吸收,C装置中最终生成氧化铜,因此样品变黑色。
(4)冷却后测得装置D增重0.9g,说明氢氧化铜分解生成了0.9g水,装置E增重4.4g,说明碳酸铜分解生成了4.4g二氧化碳,
设样品中氢氧化铜质量为x,碳酸铜的质量为y,
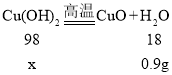
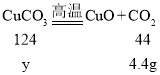
解得x=4.9g,y=12.4g
根据题意,![]()
![]()
若缺少B装置,会导致测定的水的质量偏大,从而导致测得的a:b的值会偏小。
(5)不同意,理由是氧化亚铜也是红色固体。

【题目】对下列实验现象的解释错误的是
A | B | C | D | |
实验现象 |
用扫描隧道显微镜获得的分子图像 |
品红加入水中后,整个液体变红色 |
水分子在不同温度下的运动情况 |
50mL水与50mL酒精混合后的体积小于100mL |
解释 | 分子的质量和体积都很小 | 分子总是不断的运动着的 | 常温时分子不运动,加热时分子才运动 | 分子有空隙 |
A.AB.BC.CD.D