题目内容
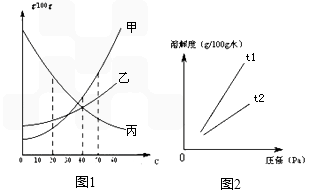
 溶解度可表示物质溶解性的大小.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.
溶解度可表示物质溶解性的大小.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.
(1)50℃时,甲的溶解度______乙的溶解度(填“>”、“<”或“=”).
(2)40℃时,乙和丙______形成溶质质量分数相同的饱和溶液(填“能”或“不能”).
(3)20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃.请填写下表
| 烧杯中的溶质 | 烧杯中固体的变化 |
| 甲 | ______ |
| 乙 | 固体逐渐减少至全部溶解 |
| 丙 | ______ |
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量一定变大
E.该饱和溶液还可以溶解其它物质
(5)通常情况下,在实验室用固体甲配制一定溶质质量分数的甲溶液,需用到的仪器有:托盘天平(带砝码盒)、烧杯和______.
A.酒精灯 B.药匙 C.玻璃棒 D.漏斗 E.铁架台 F.量筒 G.胶头滴管.
解:(1)50℃时,甲的溶解度>乙的溶解度;
(2)40℃时,乙和丙的溶解度相等,故可以形成乙和丙溶质质量分数相等的饱和溶液;
(3)甲和乙的溶解度随温度的升高而逐渐增大,且20℃至50℃时甲的溶解度变化比乙大,而乙固体能全部溶解,所以升高温度烧杯中的甲固体也将逐渐减少,至全部溶解;丙的溶解度随温度的升高而逐渐减小,所以升高温度,丙烧杯中固体的质量将逐渐增加;
(3)A、把甲物质的不饱和溶液变为饱和溶液可以用加入溶质,此时溶剂质量不变,故A错;
B、把甲物质的不饱和溶液变为饱和溶液可以用蒸发溶剂的方法,此时溶质质量不变,故B正确;
C、如果用降低温度的方法,刚好饱和时溶质质量分数是不变的,故C错;
D、如果用降低温度的方法,刚好饱和时,溶液质量不变,故D错;
E、甲的饱和溶液只是对于甲来说是饱和的,对于其他物质是不饱和的,可以再溶解其他物质,故E正确;
(4)配制溶液需要用到的仪器有:烧杯、玻璃棒、量筒、胶头滴管、天平、药匙;
故答案为:
(1)>; (2)能;
(3)
(4)BE; (5)BCFG.
分析:(1)据溶解度曲线可以比较同一温度下物质的溶解度大小;
(2)同一温度下物质的溶解度相等则饱和溶液中溶质的质量分数相等;
(3)根据三种物质的溶解度随温度的变化进行分析解答;
(4)根据甲物质的不饱和溶液变为饱和溶液的方法逐项分析解答;
(5)根据配制溶液需要的仪器回答.
点评:解答本题关键是要知道溶解度曲线表示的意义,知道溶解度如何比较大小,饱和溶液与不饱和溶液的相互转化,配制溶液需要的仪器等,并能结合题意分析解答.
(2)40℃时,乙和丙的溶解度相等,故可以形成乙和丙溶质质量分数相等的饱和溶液;
(3)甲和乙的溶解度随温度的升高而逐渐增大,且20℃至50℃时甲的溶解度变化比乙大,而乙固体能全部溶解,所以升高温度烧杯中的甲固体也将逐渐减少,至全部溶解;丙的溶解度随温度的升高而逐渐减小,所以升高温度,丙烧杯中固体的质量将逐渐增加;
(3)A、把甲物质的不饱和溶液变为饱和溶液可以用加入溶质,此时溶剂质量不变,故A错;
B、把甲物质的不饱和溶液变为饱和溶液可以用蒸发溶剂的方法,此时溶质质量不变,故B正确;
C、如果用降低温度的方法,刚好饱和时溶质质量分数是不变的,故C错;
D、如果用降低温度的方法,刚好饱和时,溶液质量不变,故D错;
E、甲的饱和溶液只是对于甲来说是饱和的,对于其他物质是不饱和的,可以再溶解其他物质,故E正确;
(4)配制溶液需要用到的仪器有:烧杯、玻璃棒、量筒、胶头滴管、天平、药匙;
故答案为:
(1)>; (2)能;
(3)
| 烧杯中的溶质 | 烧杯中固体的变化 |
| 甲 | 固体逐渐减少,至全部溶解 |
| 乙 | 固体逐渐减少至全部溶解 |
| 丙 | 固体逐渐增加 |
分析:(1)据溶解度曲线可以比较同一温度下物质的溶解度大小;
(2)同一温度下物质的溶解度相等则饱和溶液中溶质的质量分数相等;
(3)根据三种物质的溶解度随温度的变化进行分析解答;
(4)根据甲物质的不饱和溶液变为饱和溶液的方法逐项分析解答;
(5)根据配制溶液需要的仪器回答.
点评:解答本题关键是要知道溶解度曲线表示的意义,知道溶解度如何比较大小,饱和溶液与不饱和溶液的相互转化,配制溶液需要的仪器等,并能结合题意分析解答.

练习册系列答案
相关题目
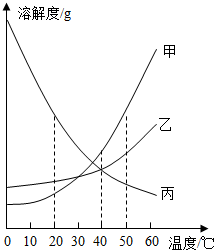
 (2012?上海)溶解度可表示物质溶解性的大小.
(2012?上海)溶解度可表示物质溶解性的大小.
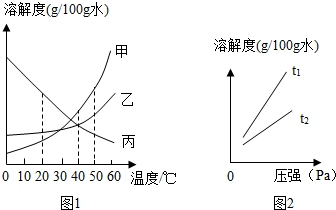
 (2013?北京一模)溶解度可表示物质溶解性的大小.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.
(2013?北京一模)溶解度可表示物质溶解性的大小.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.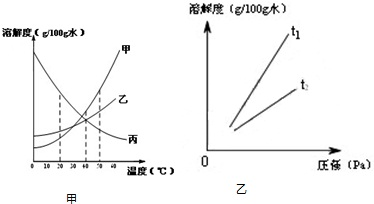 溶解度可表示物质溶解性的大小.
溶解度可表示物质溶解性的大小.