题目内容
 (2012?上海)溶解度可表示物质溶解性的大小.
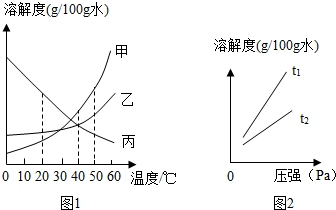
(2012?上海)溶解度可表示物质溶解性的大小.①如图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解曲线.
I.20℃时,甲溶解度
<
<
(填“>”、“<”或“=”)乙溶解度.II.40℃时,乙和丙
能
能
(填“能”或“不能”)形成溶质质量分数相同的饱和溶液.III.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃.请填表.
| 烧杯中的溶质 | 烧杯中固体的变化 |
| 甲 | 固体逐渐减少,至全部溶解 固体逐渐减少,至全部溶解 |
| 乙 | 固体逐渐减少至全部溶解 |
| 丙 | 固体逐渐增加 固体逐渐增加 |
I.打开可乐瓶,溢出大量气体,由此可见,压强越小,CO2的溶解度越
小
小
.若要加大二氧化碳溶解的量可采用的一种方法是加大压强
加大压强
.II.不同温度下,氧气的溶解度随压强的变化如图2所示,图中t1对应的温度40℃,则t2对应的温度
a
a
(填序号).a.大于40℃b.小于40℃c.无法确定.
分析:①Ⅰ、根据溶解度曲线可以判断不同的物质在同一温度下的溶解度的大小;
Ⅱ、根据溶解度曲线可以判断同一温度下两物质的溶解度大小,并进而比较饱和溶液中物质的溶质质量分数大小;
Ⅲ、根据三种物质的溶解度随温度的变化进行分析;
②Ⅰ、打开可乐瓶,溢出大量气体,由此可见,压强越小,CO2的溶解度越小,并由此分析增大气体溶解度的方法;
Ⅱ、根据气体的溶解度受温度和压强的影响情况并结合图2分析解答.
Ⅱ、根据溶解度曲线可以判断同一温度下两物质的溶解度大小,并进而比较饱和溶液中物质的溶质质量分数大小;
Ⅲ、根据三种物质的溶解度随温度的变化进行分析;
②Ⅰ、打开可乐瓶,溢出大量气体,由此可见,压强越小,CO2的溶解度越小,并由此分析增大气体溶解度的方法;
Ⅱ、根据气体的溶解度受温度和压强的影响情况并结合图2分析解答.
解答:解:①Ⅰ、根据溶解度曲线可知:甲的溶解度<乙的溶解度;
Ⅱ、40℃时,乙和丙的溶解度相同,并根据饱和溶液中质量分数的计算式
×100%可知:40℃时,可形成两种物质的溶质质量分数相同的饱和溶液;
Ⅲ、甲和乙的溶解度随温度的升高而逐渐增大,所以升高温度烧杯中的固体将逐渐减少,至全部溶解;丙的溶解度随温度的升高而逐渐减小,所以升高温度,丙烧杯中固体的质量将逐渐增加;
故答案为:
Ⅰ、<;
Ⅱ、能;
Ⅲ、
②Ⅰ、打开可乐瓶,溢出大量气体,由此可见,压强越小,CO2的溶解度越小;要使溶解的二氧化碳的量增加,可以加大压强;
Ⅱ、气体的溶解度随温度的升高而逐渐减小,由图2可知:t1时的溶解度要大于t2时的溶解度;所以t2对应的温度对应的温度要大于40℃;
故选a.
Ⅱ、40℃时,乙和丙的溶解度相同,并根据饱和溶液中质量分数的计算式
| 溶解度 |
| 溶解度+100g |
Ⅲ、甲和乙的溶解度随温度的升高而逐渐增大,所以升高温度烧杯中的固体将逐渐减少,至全部溶解;丙的溶解度随温度的升高而逐渐减小,所以升高温度,丙烧杯中固体的质量将逐渐增加;
故答案为:
Ⅰ、<;
Ⅱ、能;
Ⅲ、
| 烧杯中的溶质 | 烧杯中固体的变化 |
| 甲 | 固体逐渐减少,至全部溶解 |
| 乙 | 固体逐渐减少至全部溶解 |
| 丙 | 固体逐渐增加 |
Ⅱ、气体的溶解度随温度的升高而逐渐减小,由图2可知:t1时的溶解度要大于t2时的溶解度;所以t2对应的温度对应的温度要大于40℃;
故选a.
点评:本题考查了依据固体物质的溶解度曲线分析和解决问题的能力,及对气体溶解度的影响因素的掌握和应用,难度不大,但要结合图示根据题意细心分析解答.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目