题目内容
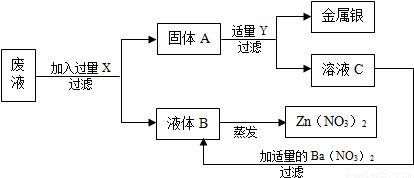
某工厂排出的废液中主要含有Zn(N03)2和AgNO3,为了回收金属银和硝酸锌,某学生设计了以下实验步骤:
试推断:X为______,Y为______,A为______ (以上均填化学式),加入适量的Ba(N03)2溶液,发生的化学方程式为______.

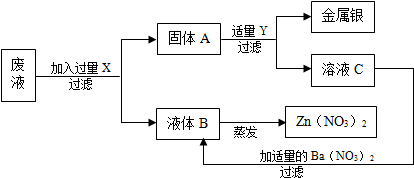
试推断:X为______,Y为______,A为______ (以上均填化学式),加入适量的Ba(N03)2溶液,发生的化学方程式为______.
废液主要含有Zn(NO3)2和AgNO3,为了从中回收金属银和硝酸锌,向废液中加入过量的锌,让锌与硝酸银反应 Zn+AgNO3=Ag+Zn(NO3)2 然后过滤,得到固体A(Zn Ag)和液体B Zn(NO3)2 溶液.为了把固体A中的银和锌分开,我们可以加入过量的Y即稀硫酸溶液,加入过量Y即稀硫酸溶液后,其中锌与稀硫酸反应会生成硫酸锌,即溶液C为硫酸锌溶液,加入适量的Ba(N03)2溶液,发生的化学方程式为:ZnSO4+Ba (N03)2=Zn(N03)2+BaS04↓.
故答案为:Zn;H2SO4;Ag、Zn;ZnSO4+Ba (N03)2=Zn(N03)2+BaS04↓.
故答案为:Zn;H2SO4;Ag、Zn;ZnSO4+Ba (N03)2=Zn(N03)2+BaS04↓.

练习册系列答案
相关题目
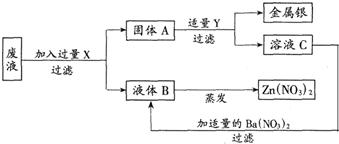
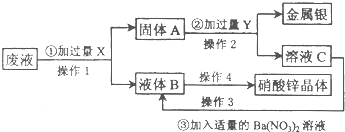 某工厂排出的废液中主要含有硝酸锌和硝酸银.为了防止环境污染并从中回收金属银和硝酸锌,设计以下方案.回答以下问题;
某工厂排出的废液中主要含有硝酸锌和硝酸银.为了防止环境污染并从中回收金属银和硝酸锌,设计以下方案.回答以下问题;