题目内容
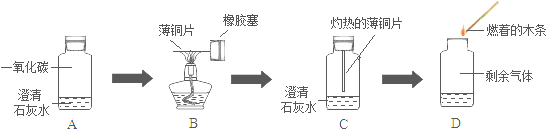
【题目】工业上制取烧碱的方法之一是电解食盐水法,在生成烧碱的同时还在两电极上产生两种气体(经检验均不是氧气),则该反应的化学方程式为_____。
某化学小组在化工商店购得某品牌的烧碱样品,准备用于化学实验。当将其配制成溶液时,小刚同学观察包装袋标签发现了问题:根据生产日期,这包烧碱存放时间较长,会不会变质呢?于是对这包烧碱进行如下探究:
(一)这包烧碱含有什么成分?
(1)打开后发现样品表面出现一层白色粉末,初步判断已经变质,出现该现象的原因是_____(用化学方程式表示)。
(2)小刚同学猜想:该包烧碱的成分可能是NaOH和Na2CO3也可能完全是Na2CO3。
(3)实验探究:
实验操作 | 现象 | 结论 |
①取少量样品于试管中,完全溶于水,滴加过量的BaCl2溶液 | 产生白色沉淀 | 含有Na2CO3 |
②取①中上层清液,滴加_____试液 | _____ | 还含有NaOH |
反思1:小红同学在实验完成后提出个人质疑:化学反应中的原料往往不能完全转化为产品,所以电解食盐水法制得的烧碱中往往会含有杂质_____(填化学式)。
所以需要进行再探究:另取上述实验①中的上层清液,滴加足量稀硝酸和AgNO3溶液,产生白色沉淀,得出结论,说明小红的质疑是正确的。
反思2:小亮认为,小红的实验设计有缺陷,理由是_____。
(二)成分含量测定
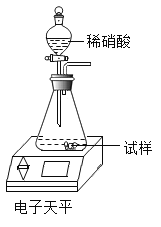
a.取样品mg放入如图装置中加水完全溶解,后放在电子天平上称量为m1g
b.打开分液漏斗活塞加入足量稀硝酸溶液,待反应停止再试样称量为m2g
c.根据化学方程式计算,样品中Na2CO3的质量分数=_____(写出表达式即可,Na2CO3、CO2的相对分子质量分别为106、44)
【答案】
![]() 酚酞试液 溶液变红色 NaCl 氯化钡溶液与硝酸银溶液也能产生白色沉淀
酚酞试液 溶液变红色 NaCl 氯化钡溶液与硝酸银溶液也能产生白色沉淀 ![]()
【解析】
氯化钠和水在通电的条件下生成氢氧化钠、氢气和氯气,化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(一)(1)氢氧化钠和二氧化碳反应生成碳酸钠和水,化学方程式为:CO2+2NaOH═Na2CO3+H2O;
(3)酚酞遇碱变红色,所以
实验操作 | 现象 | 结论 |
①取少量样品于试管中,完全溶于水,加足量BaCl2溶液 | 产生白色沉淀 | 含有Na2CO3 |
②取①中上层清液,滴加酚酞试液 | 溶液变红色 | 还含有NaOH |
反思1:电解食盐水法制取烧碱的过程中,氯化钠不能完全反应,所以电解食盐水法制得的烧碱中往往会含有杂质NaCl;
反思2:小亮认为,小红的实验设计有缺陷,理由是:氯化钡溶液与硝酸银溶液也能产生白色沉淀;
(二)根据实验数据,反应生成二氧化碳的质量为:m1g-m2g
设样品中Na2CO3的质量为x,
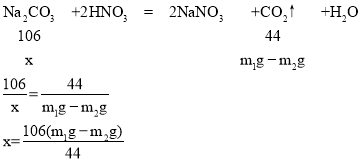
故样品中Na2CO3的质量分数为:![]()
故答案为:(1)2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(一)(1)CO2+2NaOH═Na2CO3+H2O;
(3)酚酞试液;溶液变红色;
反思1:NaCl;
反思2:氯化钡溶液与硝酸银溶液也能产生白色沉淀;
(二)![]() 。
。

 阅读快车系列答案
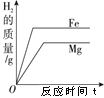
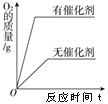
阅读快车系列答案【题目】下列图像能正确反映对应变化关系的是( )
|
|
|
|
A.用酒精灯加热一定质量的高锰酸钾 | B.将等质量的镁片和铁片投入到足量的稀H2SO4中 | C.用等质量、等浓度的双氧水分别制取氧气 | D.将水通电电解一段时间 |
A. A B. B C. C D. D
【题目】为一定条件下,密闭容器内发生的某化学反应,测得t1和t2时各物质的质量见下表,下列说法正确的是(____)
物质 | M | N | P | Q |
t1时的质量/g | 51 | 9 | 3 | 17 |
t2时的质量/g | 23 | 3 | x | 51 |
A 该反应一定是化合反应
B Q可能是单质
C P一定是该反应的催化
D 参加反应的M与N的质量比为_____