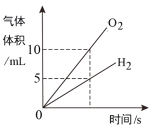
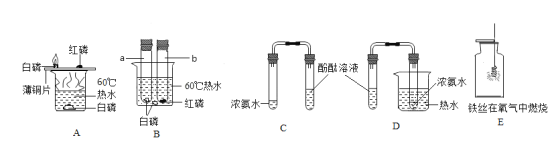
题目内容
【题目】嫦峨四号探测器成功着陆在月球背面,是新时代中国人民攀登世界科技高峰的新标杆新高度。嫦娥四号探测器使用了铝、铁、铜、锰(Mn)等金属材料。
(1)铝的化学性质很活动,但铝制品很耐腐蚀的原因是_______
(2)相同条件下,将外形相同的金属锰和铝分别与相同浓度的盐酸反应,锰产生的气体不如铝剧烈,则金属活动性Mn_____Al(选填“>”“=”或“<”)。Mn能与稀硫酸发生置换反应生成+2价化合物,写出该反应的化学方程式_______
(3)实验室制备金属锰的一种方法是4Al+3MnO2![]() 3Mn+2X,则X的化学式为______。
3Mn+2X,则X的化学式为______。
(4)向含有Fe(NO3)2和Cu(NO3)2的混合溶液中加入一定质量的铝粉,充分反应后过滤,向滤渣中加入稀硫酸,有气泡产生,则滤液中不一定含有的物质是________(填化学式)。
【答案】铝制品表面生成一层致密的氧化铝薄膜,起保护作用 < Mn+H2SO4=MnSO4+H2↑ Al2O3 Fe(NO3)2
【解析】
(1)铝的化学性质很活动,但铝制品很耐腐蚀的原因是铝的化学性质稳定,常温下能与空气中的氧气反应,在铝制品表面生成一层致密的氧化铝薄膜,起保护作用,阻止铝的进一步锈蚀;
(2)在金属活动顺序表中,金属的位置越靠前,金属的活动性越强,反应越剧烈。相同条件下,将外形相同的金属锰和铝分别与相同浓度的盐酸反应,锰产生气体不如铝剧烈,则金属活动性Mn<Al。Mn能与稀硫酸发生置换反应生成+2价化合物,该反应的化学方程式Mn+H2SO4=MnSO4+H2↑ ;
(3)化学反应前后原子的种类、个数、质量不变,实验室制备金属锰的一种方法是4Al+3MnO2![]() 3Mn+2X,则X的化学式为Al2O3;
3Mn+2X,则X的化学式为Al2O3;
(4)金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。向含有Fe(NO3)2和Cu(NO3)2的混合溶液中加入一定质量的铝粉,铝先与硝酸铜反应生成硝酸铝和铜,硝酸铜完全反应后,铝与硝酸亚铁反应生成硝酸铝和铁,充分反应后过滤,向滤渣中加入稀硫酸,有气泡产生,说明有活泼金属,则固体中一定有铁,可能有铝,则滤液中一定不含硝酸铜,一定含有硝酸铝,不一定含有的物质是Fe(NO3)2。

 口算题天天练系列答案
口算题天天练系列答案【题目】金属镍可用于制造货币、不锈钢等。粗制氧化镍主要含氧化镍(NiO),以及少量氧化钻(CoO)和氧化铁,以粗制氧化镍为原料制备纯镍的流程如下:
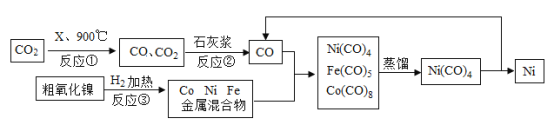
(1)反应①中,反应物X可能是_____。
(2)石灰浆是氢氧化钙的悬浊液,试写出反应②中发生的主要反应的化学方程式:_____。
(3)操作安全说明中要求反应③开始前“用氮气充分吹扫设备内部”的目的是_____。
(4)由下表推知:从Ni(CO)4、Fe(CO)5和Co2(CO)8的混合物中用蒸馏的方法提取Ni(CO)4应选择的温度(T)范围是_____。
物质 | Ni(CO)4 | Fe(CO)5 | Co2(CO)8 |
沸点/℃ | 43 | 106 | 52 |
(5)在以上生产流程中循环使用CO的目的是_____。
【题目】依据下列实验室制取气体的发生和收集装置,选择“I”或“II”进行作答,二者均作答,按“I”进行计分。
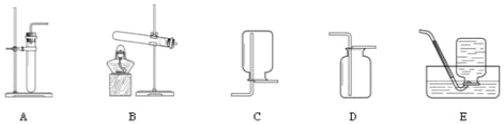
I | II |
(1)实验室用高锰酸钾制取氧气的化学方程式是_____,发生装置选择_____。 (2)氧气可选用E进行收集,其原因是_____。 | (1)实验室制取二氧化碳的化学方程式是_____,收集装置选择_____。 (2)二氧化碳的验满方法是_____。 |
【题目】工业上制取烧碱的方法之一是电解食盐水法,在生成烧碱的同时还在两电极上产生两种气体(经检验均不是氧气),则该反应的化学方程式为_____。
某化学小组在化工商店购得某品牌的烧碱样品,准备用于化学实验。当将其配制成溶液时,小刚同学观察包装袋标签发现了问题:根据生产日期,这包烧碱存放时间较长,会不会变质呢?于是对这包烧碱进行如下探究:
(一)这包烧碱含有什么成分?
(1)打开后发现样品表面出现一层白色粉末,初步判断已经变质,出现该现象的原因是_____(用化学方程式表示)。
(2)小刚同学猜想:该包烧碱的成分可能是NaOH和Na2CO3也可能完全是Na2CO3。
(3)实验探究:
实验操作 | 现象 | 结论 |
①取少量样品于试管中,完全溶于水,滴加过量的BaCl2溶液 | 产生白色沉淀 | 含有Na2CO3 |
②取①中上层清液,滴加_____试液 | _____ | 还含有NaOH |
反思1:小红同学在实验完成后提出个人质疑:化学反应中的原料往往不能完全转化为产品,所以电解食盐水法制得的烧碱中往往会含有杂质_____(填化学式)。
所以需要进行再探究:另取上述实验①中的上层清液,滴加足量稀硝酸和AgNO3溶液,产生白色沉淀,得出结论,说明小红的质疑是正确的。
反思2:小亮认为,小红的实验设计有缺陷,理由是_____。
(二)成分含量测定

a.取样品mg放入如图装置中加水完全溶解,后放在电子天平上称量为m1g
b.打开分液漏斗活塞加入足量稀硝酸溶液,待反应停止再试样称量为m2g
c.根据化学方程式计算,样品中Na2CO3的质量分数=_____(写出表达式即可,Na2CO3、CO2的相对分子质量分别为106、44)