题目内容
【题目】海洋是巨大的资源宝库、国防金属——镁,就是利用海水制取的。工业上从海水中提取单质镁的过程如下图所示:

⑴在上述转化过程中发生中和反应的步骤是_____________(填序号)。
⑵海水中本身就含有氯化镁,请分析①、②两步再得到氯化镁的目的是__________________________。
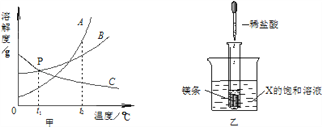
⑶小明同学在实验室中用NaOH溶液替代石灰乳模拟生产过程中的第①步,他取NaCl和MgCl2的固体混合物25g,加入适量水完全溶解后,与溶质质量分数为20%的NaOH溶液混合充分反应,记录生成的沉淀与加入NaOH溶液质量关系如图所示:

①当滴入上述NaOH溶液至图中B点时,烧杯中溶液里含有的溶质为_______________(写化学式)。
②当滴入上述NaOH溶液80g时,试通过计算,求此时烧杯中所得不饱和溶液中溶质的质量(计算结果精确至0.1g)。
【答案】(1)②;(2)富集镁元素;(3)①NaCl、NaOH;②29.4g
【解析】(1)酸和碱生成盐和水的反应叫中和反应;(2)海水中氯化镁的含量很低,经过①、②两步可得到纯净的氯化镁,达到富集镁元素的目的;(3)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,所以反应后的溶液中一定有氯化钠,B点时氢氧化钠过量,所以溶液中的溶质为NaCl、NaOH;②当滴入上述NaOH溶液80g时,氢氧化钠的质量为 80g×20%=16g。设生成氯化钠的质量为x,氯化镁的质量为y .
MgCl2+2NaOH==2NaCl+Mg (OH)2↓
95 80 117
y 16g x
95/y=80g/16g y=19g
80/16g=117/x x=23.4g
反应后所得溶液中的溶质质量为:25g-19g+23.4g=29.4g

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】以下是我们日常生活中常用的清洗剂,其名称及有效成分如下表:
清洗剂的名称 | 洁厕灵 | “84”消毒液 | 污渍爆炸盐 | 活氧彩漂 |
有效成分 | 盐酸 | NaClO | 过碳酸钠 | 过氧化氢 |
(1)“洁厕灵”可以清除铁锈(主要成分是氧化铁),写出该反应的化学方程式________。
(2)“洁厕灵”与“84”消毒液混合会发生如下反应:2HCl+NaClO═X+H2O+Cl2↑,对人体造成伤害。下列说法不正确的是___________(填序号)。
①物质X由离子构成
②NaClO中氯元素的化合价为-1
③“洁厕灵”能用于清除水垢(主要成分是碳酸钙和氢氧化镁)
④对人体造成伤害的物质是氯气
(3)“污渍爆炸盐”溶于水,生成Na2CO3和H2O2,再加入足量的“洁厕灵”,产生能使澄清石灰水变浑浊的气体,写出产生该气体的化学方程式_______________________。
(4)“活氧彩漂”可用于漂洗衣物、杀菌消毒等,原因是其有效成分过氧化氢分子中含有“过氧基”(—O—O—)。据此推测,下列物质中可用作杀菌消毒剂的是________(填序号)。
【题目】金属材料与人类的生产和生活密切相关。请回答下列问题:
(1)下列用品中,主要利用金属导电性的是_____(填序号)。
A.铂金饰品 B.铁锅 C.铜导线 D.铝合金门窗
(2)为验证锌、铁、铜三种金属的活动性顺序,丽丽和强强同学设计了不同的实验方案进行实验,都达到了实验目的。他们所用的试剂有锌片、铁片、铜片、硫酸锌溶液、硫酸亚铁溶液、硫酸铜溶液。实验方案如下:
实验方案 | 方案一 | 方案二 |
实验操作 | 一种金属放入两种溶液中
| 两种金属同时放入一种溶液中
|
①方案一中有关反应的化学方程式是______________________________;
②方案二中选择的溶液是__________________溶液。
③军军同学又设计了一个新的方案,也能达到实验目的。将三种金属分别放入一种溶液中,该溶液中的溶质在物质分类上和前两位同学所用的试剂不同,他选择的溶液是____________________。
【题目】下列有关“物质性质—类别—用途”的对应关系中正确的是( )
选项 | 物质性质 | 类别 | 用途 |
A | 氢氧化钠具有腐蚀性 | 化学性质 | 制作叶脉书签 |
B | 液氮气化时会吸热 | 物理性质 | 用作保护气 |
C | 生石灰遇水放热 | 物理性质 | 用作干燥剂 |
D | 活性炭具有吸附性 | 化学性质 | 用于制糖工业脱色 |
A. A B. B C. C D. D