题目内容
【题目】铜和铁是生产、生活中广泛使用的金属.
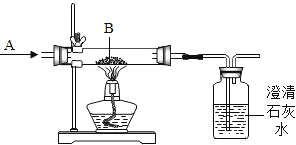
(1)下图是工业炼铁原理的实验示意图.气体A是_____和红棕色粉末B是_____.广口瓶中可观察到的现象是_____;用化学方程式表示炼铁的反应原理是_____;该实验中尾气的处理方法可以为_____.
(2)铁生锈的条件是_____;铜表面也容易生成绿色的铜锈,铜锈的主要成分是碱式碳酸铜,化学式为_____.
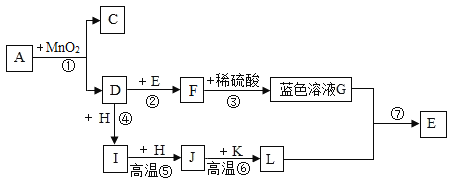
(3)老师用生锈的铜片、铁粉和稀硫酸进行实验,实验过程如图所示(部分生成物己略去).
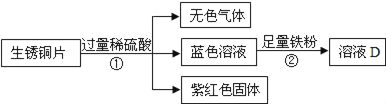
紫红色固体C的化学式为_____.写出反应②中反应的化学方程式_____.
【答案】CO Fe2O3 澄清石灰水变浑浊 Fe2O3+3CO![]() 2Fe+3CO2 点燃或用气球收集 与潮湿的空气接触 Cu2(OH)2CO3 Cu Fe+CuSO4═FeSO4+Cu,Fe+H2SO4═FeSO4+H2↑
2Fe+3CO2 点燃或用气球收集 与潮湿的空气接触 Cu2(OH)2CO3 Cu Fe+CuSO4═FeSO4+Cu,Fe+H2SO4═FeSO4+H2↑
【解析】
(1)工业炼铁原理是用一氧化碳还原红棕色的氧化铁粉末,生成二氧化碳、铁,反应方程式为:Fe2O3+3CO![]() 2Fe+3CO2,二氧化碳可以与氢氧化钙反应生成碳酸钙沉淀和水,广口瓶中可观察到的现象是澄清石灰水变浑浊;实验过程中未反应的一氧化碳有毒,不能直接排入空气中,可以将其点燃或收集起来;
2Fe+3CO2,二氧化碳可以与氢氧化钙反应生成碳酸钙沉淀和水,广口瓶中可观察到的现象是澄清石灰水变浑浊;实验过程中未反应的一氧化碳有毒,不能直接排入空气中,可以将其点燃或收集起来;
(2)铁生锈是铁与氧气、水共同作用的结果,铁在潮湿的空气中生锈生成铁锈,铜在潮湿的空气中也会生锈,铜锈称为铜绿,主要成分是碱式碳酸铜,化学式是Cu2(OH)2CO3;
(3)该实验流程为:生锈铜片表面的主要成分是 Cu2(OH)2CO3,它可以与硫酸反应生成无色的二氧化碳气体、蓝色的硫酸铜溶液,当表面的铜锈反应完全后露出红色的铜;蓝色的硫酸铜溶液中还有剩余的稀硫酸,所以向蓝色的硫酸铜溶液中加入铁粉时,铁与硫酸铜溶液反应生成硫酸亚铁和铜,反应方程式为:Fe+CuSO4═FeSO4+Cu,铁又会与稀硫酸反应生成硫酸亚铁和氢气,反应方程式为:Fe+H2SO4═FeSO4+H2↑。

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案