题目内容
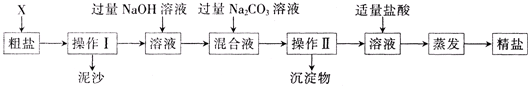
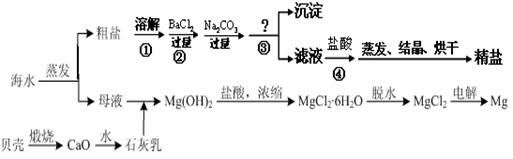
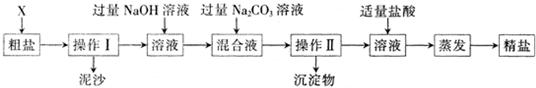
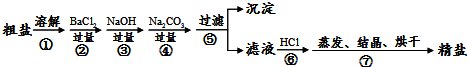
通过海水晾晒可得粗盐和母液,粗盐除NaCl外,还含有CaCl2、Na2SO4以及泥沙等杂质。海水可同时生产氯化钠和金属镁或镁的化合物等产品,其流程如下图所示:
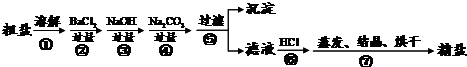
(1)制得粗盐和精盐的操作都包括蒸发步骤,有关其中“蒸发”步骤的叙述错误的是________。
a. 蒸发的目的是得到热饱和溶液 b. 蒸发的目的是析出晶体
c. 应用余热蒸干溶液 d. 应蒸发至有较多晶体析出时为止
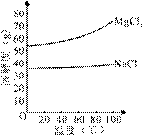
(2)由MgCl2溶液得到MgCl2·6H2O也需要蒸发,根据溶解度曲线,蒸发的目的是_________。(填写“得到热饱和溶液”或“析出晶体”)
(3)在第①步粗盐溶解操作中要用玻璃棒搅拌,其作用是 ;第②步加试剂的目的是除去粗盐中的 (填化
学式),第④步加入盐酸的目的是 。
(4)该流程的副产品中,除钙元素能被海洋生物利用外,还需综合利用的物质是_________。
(5)MgCl2可电解制Mg,MgO则是重要的耐火材料。在550℃时,MgCl2·6H2O会分解生成MgO、MgCl2、HCl和水,其中MgO、MgCl2的物质的量
之比为3:1,该反应的化学方程式为
;若不补充其它原料,还可制得溶质质量分数为_______%的盐酸。(计算结果精确到0.1)
(6)电解食盐水所得溶液中的溶质主要为氢氧化钠和氯化钠(其它溶质可忽略不计),已测得该溶液的密度为1.2 g/mL,为进一步测定其中氢氧化钠的含量,取该溶液样品25 mL与10%的稀硫酸反应,当加入49g稀硫酸时恰好完全中和。请根据化学方程式列式计算:
①25 mL该溶液样品中含氢氧化钠多少克?
②该溶液样品中氢氧化钠的质量分数是多少?
(1)ac
(2)得到热饱和溶液
(3)搅拌,加速溶解 Na2SO4 除却过量的Na2CO3
(4)Cl2、BaSO4、BaCO3
(5)4MgCl2·6H2O![]() 3MgO+MgCl2+6HCl+21H2O 36.7
3MgO+MgCl2+6HCl+21H2O 36.7
(6)n(H2SO4)=49×10%/98=0.05(mol)
2NaOH+H2SO4![]() Na2SO4+2H2O
Na2SO4+2H2O
2 1
x 0.05
![]() x=0.1(mol)
x=0.1(mol)
0.1×40=4(g)![]()
3.(1)CO2和CO H2
(2)在装置A、B之间增加一个干燥装置
4.(1)气球胀大
(2)指示氢氧化钠与盐酸是否完全反应
(3)【交流讨论】① NaCl ②氢氧化钠(合理答案均可) 【实验设计】CaCl2(或BaCl2) ①

 导学全程练创优训练系列答案
导学全程练创优训练系列答案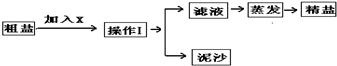
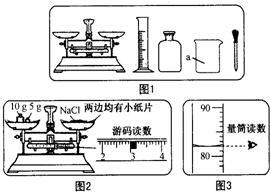 某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验:
某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验: