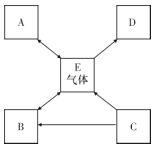
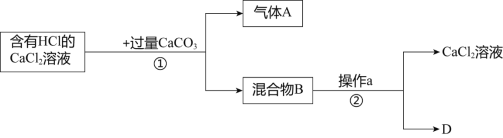
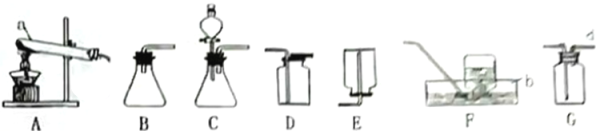
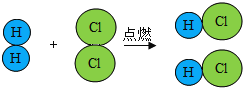
题目内容
【题目】某化学兴趣小组对某铜锌合金样品进行探究实验.称取样品10.0克,再用100.0克稀硫酸溶液逐滴滴入,实验情况如图所示.求:
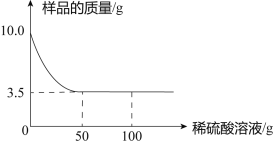
(1)铜锌合金中,铜的质量分数是_____________.
(2)所用稀硫酸溶液为50g时,反应所得溶液中溶质的质量分数是多少_______?
【答案】35% 28.6%
【解析】
在铜锌合金中,铜不能与硫酸反应,锌与硫酸反应生成可溶的硫酸锌和水。由图可以看出6.5g的锌和50g的稀硫酸恰好完全反应,据此结合对应的化学方程式求算氢气的质量和硫酸锌的质量,进而求算所得溶液中溶质的质量分数,也可以用溶液差量法求算硫酸锌以及所得溶液的质量,进而求算其质量分数。
在铜锌合金中,铜不能与硫酸反应,锌与硫酸反应生成可溶的硫酸锌和水。由图可以看出6.5g的锌和50g的稀硫酸恰好完全反应,在铜锌合金中,铜的质量分数= ![]() =35.0%。
=35.0%。
设:生成的硫酸锌的质量为x,生成的氢气的质量为y

![]() x=16.1g
x=16.1g
![]() y=0.2g
y=0.2g
反应所得溶液中溶质的质量分数为![]() ≈28.6%
≈28.6%
(1)铜锌合金中,铜的质量分数是 35.0%。
(2)所用稀硫酸溶液为50g时,反应所得溶液中溶质的质量分数是28.6%。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案【题目】下表是硝酸钾在不同温度下的溶解度:
温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 |
溶解度(g) | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 | 202 |
(1)从表可知,在60℃时,50克水中最多可以溶解硝酸钾__________克.
(2)烧杯A是70℃时,含有100g水的硝酸钾不饱和溶液,经过如图的变化过程(在整个过程中,不考虑水分的蒸发),则到C烧杯中溶液的溶质质量分数为_________.

(3)若要从含有硝酸钾与少量氯化钠的混合物中提纯硝酸钾适宜采用__________结晶的方法.
(4)硝酸钾在农业生产中是一种化肥,它属于___________.
A.氮肥 B.磷肥 C.钾肥 D.复合肥 E.微量元素肥