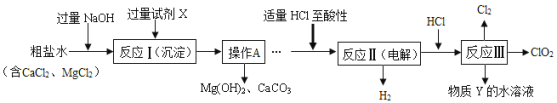
题目内容
【题目】某化学兴趣小组围绕“酸碱中和反应”,在老师引导下开展探究活动.
探究:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果不可以认为稀盐酸与NaOH溶液发生了反应,你认为他的理由____.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
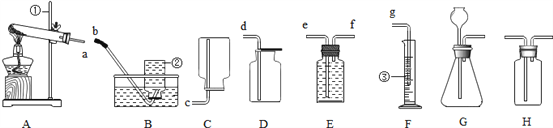
【药品仪器】
①取____(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:____;
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选取了AgNO3溶液、紫色石蕊试液、铁锈粉末设计实验方案,请你分析并判断:
实验方案 | 实验步骤 | 现象 | 结论 |
① | 取样,加入适量的AgNO3溶液 | 出现白色沉淀 | 稀盐酸过量 |
② | 取样,加入几滴紫色石蕊试液 | 溶液变红 | 稀盐酸过量 |
③ | 取样,加入铁锈粉末 | 稀盐酸过量 |
方案③中反应的化学方程式____.上述设计方案中,不正确的是____(填“①”、“②”或“③”),错误的原因是____;
(3)碱与酸反应不一定都无明显现象,写出一个有沉淀生成的中和反应:____.
【答案】 氢氧化钠溶液中加水稀释pH也会减小 A 取少量水将其溶解加入CuSO4溶液,无蓝色沉淀或取少量的固体溶于水,无放热现象 红棕色粉末逐渐减少,溶液变成黄色 ① 反应生成的NaCl也能与AgNO3 反应生成白色沉淀,不能证明溶液中含有盐酸 Ba(OH)2+H2SO4===BaSO4↓+2H2O
【解析】探究:证明氢氧化钠溶液与稀盐酸确实能发生反应。测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,有的同学认为根据这个测定结果不可以认为稀盐酸与NaOH溶液发生了反应,他的理由是.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH小于7.
结论:氢氧化钠溶液中加水稀释pH也会减小,稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.。【方案2】借助于无色酚酞试液。【药品仪器】①取A中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生。【思考拓展】(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取少量水将其溶解加入CuSO4溶液,无蓝色沉淀或取少量的固体溶于水,无放热现象。(2)探究步骤②中无色溶液中稀盐酸是否过量。选取了AgNO3溶液、紫色石蕊试液、铁锈粉末设计实验方案。
实验方案 | 实验步骤 | 现象 | 结论 |
① | 取样,加入适量的AgNO3溶液 | 出现白色沉淀 | 稀盐酸过量 |
② | 取样,加入几滴紫色石蕊试液 | 溶液变红 | 稀盐酸过量 |
③ | 取样,加入铁锈粉末 | . 红棕色粉末逐渐减少,溶液变成黄色。 | 稀盐酸过量 |
方案③中反应的化学方程式是Fe+2HCl=FeCl2 +H2 ↑, 上述设计方案中,不正确的是①, 错误的原因是反应生成的NaCl也能与AgNO3 反应生成白色沉淀,不能证明溶液中含有盐酸。
﹙ 3)碱与酸反应不一定都无明显现象,写出一个有沉淀生成的中和反应:Ba(OH)2+H2SO4 =BaSO4↓+2H2O。
点睛∶本题主要考探究查酸碱中和反应的进程。

【题目】除去下列物质中的少量杂质,所选用的试剂或操作方法错误的是( )
选项 | 物质 | 杂质 | 试剂 | 操作方法 |
A | H20 | 油污 | 活性炭 | 振荡、搅拌 |
B | 空气 | 甲醛 | 过量焦炭 | 通过焦炭净化器 |
C | CO | 水蒸气 | 足量生石灰 | 通过生石灰的干燥管 |
D | NaNO3溶液 | Na2CO3 | 适量Ca(NO3)2溶液 | 过滤,蒸发结晶 |
A. A B. B C. C D. D