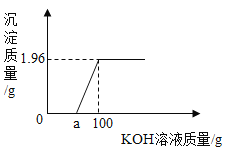
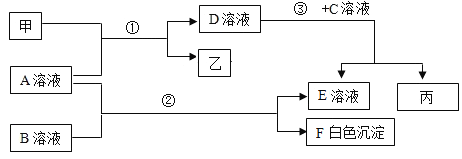
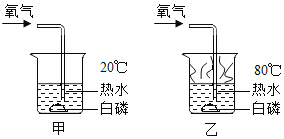
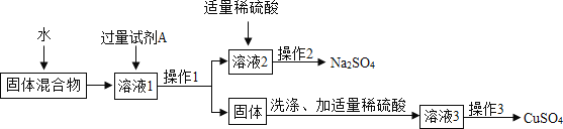
题目内容
【题目】甲、乙两种物质的溶解度曲线如图所示。下列有关说法正确的是()
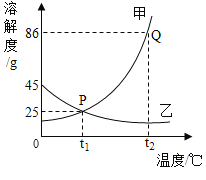
A.t1℃时,甲、乙的饱和溶液中溶质质量相等
B.甲的溶解度比乙的大
C.若甲中混有少量的乙,可采用降温结晶的方法提纯甲
D.t2℃时,甲的饱和溶液溶质质量分数为86%
【答案】C
【解析】
A、t1℃时,甲、乙两种物质的溶解度相等,但是饱和溶液的质量不能确定,所以饱和溶液中溶质的质量不能确定,故错误;
B、甲的溶解度比乙大错误,因为没有指明温度,故错误;
C、甲固体物质的溶解度随温度升高而增大,而乙的溶解度随温度的升高而减少,若甲中混有少量的乙,可采用降温结晶的方法提纯甲,故正确;
D. t2℃时,甲的溶解度为86g,甲的饱和溶液溶质质量分数为![]() 86%,故错误。
86%,故错误。
故选:C。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案【题目】请根据下列实验装置图回答问题:

(1)写出仪器的名称①:____________;②_____________。
(2)实验室制取二氧化碳可选择的装置是___________,反应原理是__________________(用化学方程式表示),收集装置不能用C的原因是_________。
(3)实验室用高锰酸钾制取氧气时,要选用A装置,试管口略向下倾斜的目的是防止试管口的冷凝水回流到试管底部,炸裂试管。同学们对水的来源产生了兴趣,进行了如下探究。
[提出问题]试管口的水来自哪里?
[猜想与假设]
猜想1:高锰酸钾分解产生的水
猜想2:试管内空气中的水蒸气
猜想3:高锰酸钾固体含有水分
小莉认为猜想1不正确,理由是_________________。
[实验验证]同学们设计了以下方案进行验证。
实验方案 | 实验操作 | 实验现象 | 实验结论 |
方案一 | 用A装置,不加药品加热一段时间 | __________ | 猜想2不成立 |
方案二 | 将高锰酸钾先在酒精灯上加热干燥,再用A、C装置进行实验 | __________ | 猜想3成立 |
[交流与评价]方案二中先将高锰酸钾在酒精灯上加热干燥的目的是_____________。
[拓展延伸]实验室的化学试剂多数需要密封保存。下列实验室试剂要密封保存的目的正确的______________。
A纯碱密封保存防止与空气中的二氧化碳反应而变质
B白磷密封存于水中,防止发生自燃
C浓盐酸密封保存防止吸收空气中的水分使其浓度降低
【题目】化学物质之间的反应奥妙无穷。在一次化学探究活动中,同学们从不同角度对稀盐酸与氢氧化钠溶液的反应进行了探究:
(1)探究稀盐酸与氢氧化钠溶液发生了反应,同学们设计了实验方案一:
实验步骤 | 实验现象 | 结论 |
取少量稀盐酸,先用pH试纸测定稀盐酸的pH,再逐渐滴加氢氧化钠溶液,并不断振荡,同时测定混合液的pH. | pH逐渐变大至pH=7,最后pH>7 | 稀盐酸与氢氧化钠溶液能发生反应 |
①请你分析上述方案中为什么强调只有测得的pH=7,最后pH>7才能证明反应发生了?______。
②写出稀盐酸与氢氧化钠溶液反应的化学方程式______。
(2)探究稀盐酸与氢氧化钠溶液反应是放热的,同学们设计了实验方案二:
取20℃时的NaOH溶液10mL于烧杯中,逐滴滴入稀盐酸,然后用温度计测量溶液温度。随着盐酸的加入,烧杯中溶液温度与加入盐酸体积之间的变化关系如图一所示:
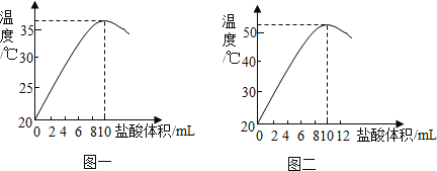
①滴加至8mL时,充分搅拌后滴入紫色石蕊试液,溶液呈______色,盐酸滴加至______mL时,溶液呈中性。
②继续滴加盐酸,溶液的温度下降的原因是______。是否可以用NaOH固体代替氢氧化钠溶液探究中和反应是否放热?______(填“是”或“否”)。
(3)小强同学对方案二的实验有异议,他找到了前几天所做的实验数据记,图二是烧杯中溶液温度与加入盐酸体积之间的变化关系图,造成两位同学所测溶液温度有差异的原因可能是:①______,②______。