题目内容
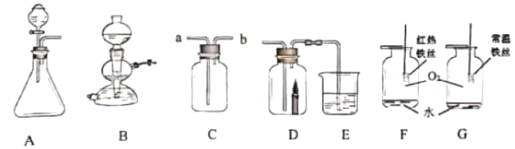
【题目】为减少煤对环境的污染,提高煤的综合利用率。如图是某厂设想利用煤为原料对生产硫酸亚铁的流程进行如下探究,请根据图示,回答下列问题:
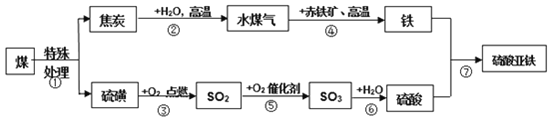
(1)水煤气的主要成分是两种还原性气体,它们分别是______、______(写化学式);
(2)操作步骤②属于______(填“化学”或“物理”)变化;
(3)属于化合反应的有______(填序号);
(4)写出下列反应的化学方程式:④______(只写其中一条);⑦______。
【答案】CO H2 化学 ③⑤⑥ Fe2O3+3H2![]() 3H2O+2Fe或Fe2O3+3CO
3H2O+2Fe或Fe2O3+3CO![]() 3CO2+2Fe Fe+H2SO4=FeSO4+H2
3CO2+2Fe Fe+H2SO4=FeSO4+H2![]()
【解析】
(1)水煤气的主要成分是氢气、一氧化碳,对应的化学式为H2、CO;
(2)操作步骤②是焦炭与水在高温下反应生成一氧化碳和氢气,有新物质产生,是化学变化;
(3)②是焦炭与水在高温下反应生成一氧化碳和氢气,属于置换反应;③是硫在氧气中燃烧生成二氧化硫,为化合反应;④氧化铁和氢气在高温下反应生成铁单质和水,氧化铁和一氧化碳在高温下反应生成二氧化碳和铁,两个反应均属于置换反应;⑤为二氧化硫在氧气和催化作用下反应生成三氧化硫,属于化合反应;⑥为三氧化硫和水反应生成硫酸;⑦铁和硫酸反应生成硫酸亚铁和氢气,属于置换反应;故选③⑤⑥;
(4)反应④为氧化铁和氢气反应生成铁单质和水,氧化铁和一氧化碳反应生成二氧化碳和铁,对应的方程式为Fe2O3+3H2![]() 3H2O+2Fe,Fe2O3+3CO
3H2O+2Fe,Fe2O3+3CO![]() 3CO2+2Fe;反应⑦为铁和硫酸反应生成硫酸亚铁和氢气,对应的方程式为Fe+H2SO4=FeSO4+H2
3CO2+2Fe;反应⑦为铁和硫酸反应生成硫酸亚铁和氢气,对应的方程式为Fe+H2SO4=FeSO4+H2![]() 。
。

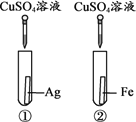
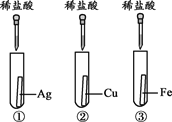
【题目】为探究金属的化学性质,设计了A、B两个方案。
方案A | 方案B |
|
|
(1)能验证三种金属活动性顺序的方案是________(填“A”或“B”)。
(2)方案B中,证明铁的活动性比铜强的现象是_____________________。
(3)有一只试管中的物质能与稀盐酸反应,原因是_________________________ 。