题目内容
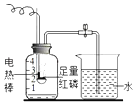
【题目】某化学活动小组探究铁的锈蚀条件过程如下:如图所示(该装置气密性良好),室温时,将包有样品的滤纸包用大头针固定在橡皮塞上,迅速塞紧橡皮塞。已知,此集气瓶净容积为146mL。一段时间后,观察到量筒内水沿导管进入集气瓶。当温度恢复至室温,且量筒内水面高度不再发生变化时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如下表。
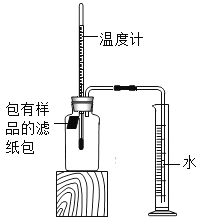
序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
Ⅰ | 1 g铁粉、0.2 g木炭粉和10滴水 | 100 | 70 | 约120 |
Ⅱ | l g铁粉、0.2 g木炭粉、10滴水和少量氯化钠 | 100 | 70 | 约70 |
根据所学知识推测:
①实验过程中,温度计示数一直升高.
②实验结束后取出Ⅰ号样品滤纸包,打开,可观察到样品的颜色变为红色.
③分析Ⅰ和Ⅱ所得数据,初步推断铁锈蚀的速率与氯化钠有关.
④ 该实验还可测量空气中氧气的含量。根据实验数据计算氧气约占空气体积的21.0%.
⑤ 现要增加一个对比实验,探究木炭对铁锈蚀速率的影响,则需增加实验的样品组成可以为1 g铁粉、0.4g木炭粉和10滴水.
⑥该实验验证了铁生锈是水和氧气等共同作用的结果.
上述正确的判断是:
A. ①②③⑥B. ②③⑥C. ①②④⑤⑥D. ②③
【答案】D
【解析】
①铁在生锈时要放出热量,从而使温度升高,但是当反应完毕后,由于热量要散失所以温度要降到室温,故说法错误;
②由于铁生锈当打开纸包后会发现铁样品变为红色(或锈红色),故说法正确;
③比较实验I和实验II可以知道实验II反应的速率要快,即氯化钠影响了铁锈蚀的反应速率,故说法正确;
④根据实验现象可以知道水减少的体积即为空气中氧气的体积,其体积为30mL,所以氧气的体积分数为:![]() ×100%≈20.5%,故说法错误;
×100%≈20.5%,故说法错误;
⑤实验I中已经有木炭粉了,所以我们只要再做一组没有木炭粉的对比实验即可,也就是用1g铁粉、10滴水来完成一个对比试验,故说法错误;
⑥没有进行对比实验,该实验不能验证铁生锈是水和氧气等共同作用的结果,故错误;
故选D。

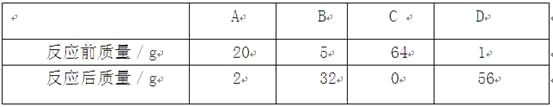
【题目】一定 条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如下表:
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量(g) | 20 | m | 8 | 6 |
反应后质量(g) | 4 | 待测 | 28 | 2 |
关于此反应,下列描述正确的是( )
A. 乙是该反应的催化剂
B. “待测”数值一定为2
C. 反应中甲与丙的质量比为1:7
D. 该反应可能是铜和氧气反应
【题目】某同学从定量角度研究双氧水制取氧气的过程,对原实验进行部分改进,增加了称量操作.具体做法是:取10%的双氧水和少量的二氧化锰放入气体发生装置,并对反应前后混合物的质量进行称量,记录如下: 若反应后,双氧水分解完全且氧气全部逸出,该同学得出的结论中,不合理的是()
反应过程 | 反应前 | 反应后 |
质量变化(不含容器质量) | 34.3g | 32.7g |
A. 反应速率逐渐加快 B. 最多得到氧气的质量为1.6g
C. 催化剂二氧化锰的质量为0.3gD. 反应得到水和氧气的质量比为9:8