题目内容
【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究。
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【查阅资料】盐酸是由氯化氢和水组成,盐酸的浓度是指氯化氢在盐酸中所占的质量分数。
【作出猜想】a.可能与金属本身的性质有关;b.可能与盐酸的浓度有关。
(1)【设计探究】实验所用金属均已用砂纸打磨。
实验一:为探究猜想a,常温下,小组同学分别在两支试管中放入相同形状、质量相等的锌片和铁片,然后分别加入质量相等、浓度相等的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。请写出放锌片的试
管中发生反应的化学方程式:。从实验现象可初步判断:金属活动性ZnFe(填“<”“=”或“>”)。
【得出结论1】金属与盐酸发生反应的剧烈程度与金属本身性质有关。
(2)实验二:为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是。
(3)【实验记录】实验数据如下表: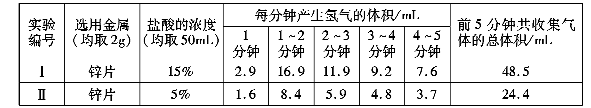
【得出结论2】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系。
【反思评价】根据表中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因。通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响?(写一条即可)。
【答案】
(1)Zn+2HCl=ZnCl2+H2↑,>
(2)测量生成气体的体积
(3)盐酸的浓度越大,反应越剧烈,锌与盐酸反应产生气体的速率先逐渐加快,后变慢,因为锌与盐酸是放热反应,所以开始时反应较慢,随温度升高,产生气体速率加快,随着反应的进行,盐酸不断被消耗,浓度降低,产生气体速度变慢。,固体的表面积(或形状)、反应的温度、金属的纯度等(合理即可)
【解析】(1).锌和盐酸反应生成氯化锌和氢气,反应方程式为: Zn+2HCl=ZnCl2+H2↑分别在两支试管中放入相同形状、质量相等的锌片和铁片,然后分别加入质量相等、浓度相等的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。说明锌与盐酸的反应比铁剧烈,在锌的活动性比铁的强; (2).实验前注射器的读数为零, 气体增多时注射器的活塞向右移动,最后停在一定刻度处,通过读取注射器停止移动时的刻度,测量生成气体的体积 (3). 通过表格中的数据可知,金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是盐酸的浓度越大,反应越剧烈;.反应速率与反应物的浓度,温度有关,通常温度越高,浓度越大反应速率越快; 锌与盐酸反应产生气体的速率先逐渐加快,后变慢,因为锌与盐酸是放热反应,所以开始时反应较慢,随温度升高,产生气体速率加快,随着反应的进行,盐酸不断被消耗,浓度降低,产生气体速度变慢。反应快慢还 与反应物间的接触面积有关,接触越充分,反应越快,所以固体的表面积(或形状)、反应的温度、金属的纯度等(合理即可)。
故答案为:Zn+2HCl=ZnCl2+H2↑;>;测量生成气体的体积;盐酸的浓度越大,反应越剧烈;锌与盐酸反应产生气体的速率先逐渐加快,后变慢,因为锌与盐酸是放热反应,所以开始时反应较慢,随温度升高,产生气体速率加快,随着反应的进行,盐酸不断被消耗,浓度降低,产生气体速度变慢;固体的表面积(或形状)、反应的温度、金属的纯度等(合理即可)。
本题主要考察影响化学反应的速率的因素,化学反应速率与反应物的接触面积、浓度、温度等有关。接触面积越大,反应越快;温度越高反应越快;浓度越大反应越快。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】我们的生活离不开化学。根据信息要求选择适当物质的编号填入下列表格的相应空格里。
信息要求 | 编号 | 信息要求 | 编号 |
(1)能吸附有异味物质的是 | ______ | (2)可用于灭火的是 | ______ |
(3)能供人呼吸的是 | ______ | (4)煤气的主要成分是 | ______ |
A氧气 B活性炭 C石油 D二氧化碳 E一氧化碳 F氢气 | |||
