题目内容
【题目】利用下图所示装置进行实验。

(1)打开K1,观察到蜡烛燃烧更剧烈,原因是________。
(2)关闭K1、打开K2,观察到B中现象______。C中反应的化学方程式________。
【答案】过氧化氢在二氧化锰的催化作用下分解生成氧气,氧气有助燃性 下层的蜡烛先熄灭,上层的蜡烛后熄灭 CaCO3+2HCl═CaCl2+H2O+CO2↑
【解析】
(1)过氧化氢在二氧化锰的催化作用下分解生成水和氧气,氧气有助燃性,所以观察到蜡烛燃烧更剧烈;
(2)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,二氧化碳密度比空气大,不助燃,不可燃,所以观察到B中现象是:下层的蜡烛先熄灭,上层的蜡烛后熄灭;C中反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑。

 阅读快车系列答案
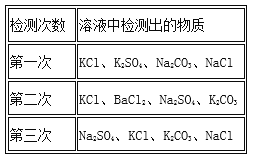
阅读快车系列答案【题目】下表中的选项不符合如图所示曲线的是
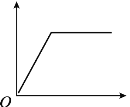
选项 | 横坐标 | 纵坐标 |
A | 向一定量稀硫酸中加入锌粉的质量 | 产生氢气的体积 |
B | 向一定量的铁粉中加入硫酸铜溶液的质量 | 固体的质量 |
C | 给一定量高锰酸钾固体加热的时间 | 产生气体的质量 |
D | 在一定温度下,向一定量的水中加入食盐晶体的质量 | 溶液中溶质的质量分数 |
A. A B. B C. C D. D
【题目】为探究影响大理石与稀盐酸反应剧烈程度的因素,某学习小组进行了探究。
(提出问题)影响大理石与稀盐酸反应剧烈程度的因素有哪些?
(猜想与假设)甲同学:__________
丙同学:溶液温度; 乙同学:酸的浓度。
(设计实验)小组同学将稀盐酸分成四等份,分别加入四支试管中进行下列对比实验。
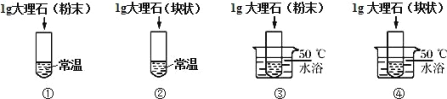
(实验验证)写出大理石与稀盐酸反应化学方程式:___________; 比较下表是同学进行的探究记录,请完善表格。
实验目的 | 对照组 | 实验现象 | 实验结论 |
探究温度对于反 应速率的影响 | ①和___________。 | ___________ | 温度越高化学反应应 速率越快 |
___________ | ③和④ | 实验③产生气泡速率比实验④快 | ___________ |