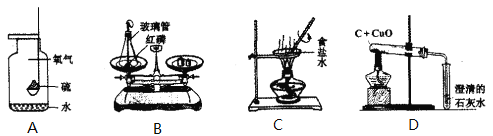
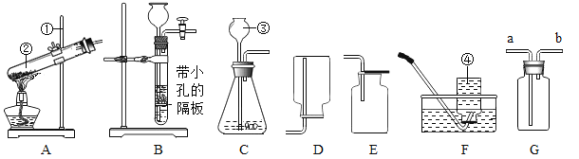
题目内容
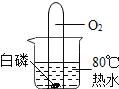
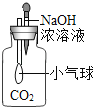
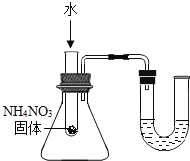
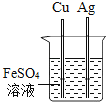
【题目】为探究影响大理石与稀盐酸反应剧烈程度的因素,某学习小组进行了探究。
(提出问题)影响大理石与稀盐酸反应剧烈程度的因素有哪些?
(猜想与假设)甲同学:__________
丙同学:溶液温度; 乙同学:酸的浓度。
(设计实验)小组同学将稀盐酸分成四等份,分别加入四支试管中进行下列对比实验。
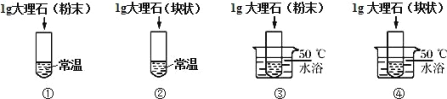
(实验验证)写出大理石与稀盐酸反应化学方程式:___________; 比较下表是同学进行的探究记录,请完善表格。
实验目的 | 对照组 | 实验现象 | 实验结论 |
探究温度对于反 应速率的影响 | ①和___________。 | ___________ | 温度越高化学反应应 速率越快 |
___________ | ③和④ | 实验③产生气泡速率比实验④快 | ___________ |
【答案】反应物的接触面积 CaCO3+2HCl=CaCl2+H2O+CO2↑ ③ 试管③中产生的气泡比试管①中的快 探究反应速率与接触面积有关 接触面积越大,反应速率越快
【解析】
(1)由设计的实验可知,甲同学的猜想是反应速率与接触面积有关。
(2)大理石与稀盐酸反应生成氯化钙、二氧化碳和水,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑。
(3)根据控制变量法,探究温度对于反应速率的影响应该选①③。
(4)由实验的结论可知,试管③中产生的气泡比试管①中的快。
(5)试管③④的不同点是大理石的大小不同,与稀盐酸的接触面积不同,故实验目的是探究反应速率与接触面积有关。
(6)接触面积越大,反应速率越快。

【题目】多彩的“碳”,多姿的生活,让我们一起走进“碳”的世界.
(1)根据表1提供的信息,填写有关含碳物质的对应特性.
物质用途 | 金刚石切割玻璃 | 石墨作电极 | 活性炭净水 |
对应性质 | ①______ | ②______ | ③______ |
(2)二氧化碳是宝贵的资源.在高温高压下,CO2和NH3可以合成尿素[CO(NH2)2],同时生成水.该反应的化学方程式为_________.
(3)目前,人类以化石燃料为主要能源.化石燃料有煤、石油和天然气,天然气中甲烷完全燃烧生成二氧化碳和水,甲烷中一定含有____元素.
(4)从表2数据分析,与煤相比,用天然气作燃料的优点有______.
1g物质完全燃烧 | ||
产生二氧化碳的质量/g | 放出的热量/kJ | |
甲烷 | 2.75 | 56 |
碳 | 3.67 | 32 |