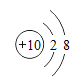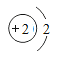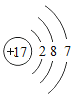题目内容
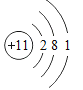
【题目】海洋是巨大的资源宝库,人类提取海水中的化学元素,来制备有多种用途的物质。广泛应用于火箭、导弹和飞机制造业的金属镁,就是利用从海水中提取的镁盐制取的。工业上从海水中提取单质镁的过程如图所示:
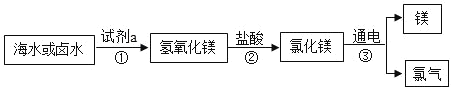
(1)为了使MgCl2转化为Mg(OH)2,在海边,把贝壳(主要成分是碳酸钙)经过多次转化而得到的试剂a的名称是___。写出步骤②所发生反应的化学方程式为___。
(2)根据流程图,判断下列说法正确的是___(填字母序号)。
A 步骤①、②的目的是从海水中提纯富集氯化镁
B 步骤②中发生的反应属于中和反应
C 步骤③中化学能转化为了电能
(3)小明同学在实验室中用 NaOH 溶液替代试剂a模拟海水制镁生产过程中的第①步。他取 NaCl 和 MgCl2的固体混合物 10g,加入100g水完全溶解后,与溶质质量分数为 2%的NaOH溶液混合充分反应,记录的生成的沉淀与加入的 NaOH 溶液质量关系如图所示:
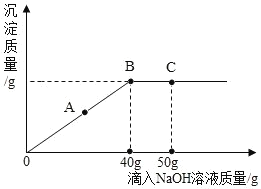
①当滴入上述NaOH溶液至图中 B点时,烧杯中溶液里含有的溶质为___(写化学式)。
②当滴入上述NaOH溶液40g时(即B点),试通过计算,求此时烧杯中所得不饱和溶液的质量(计算结果精确至 0.1g)。____________
【答案】氢氧化钙 Mg(OH)2+2HCl=MgCl2+2H2O AB NaCl 149.4g
【解析】
(1)为了使MgCl2转化为Mg(OH)2,常加入一种碱,在海边,把贝壳(主要成分是碳酸钙)碳酸钙高温分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,经过多次转化而得到的试剂a是一种碱,名称是氢氧化钙,步骤②所发生的反应是氢氧化镁与稀盐酸反应生成了氯化镁和水,化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O。
(2)A.由制取的流程图可知,步骤①、②的目的是从海水中提纯富集氯化镁,故选项正确;
B. 步骤②中发生的反应是氢氧化镁和稀盐酸反应,属于中和反应,故选项正确;
C. 步骤③中电能转化为了化学能,故选项错误;
故选:AB。
(3)①由图象可知,当滴入上述NaOH溶液至图中 B点时,氯化镁恰好与氢氧化钠反应,烧杯中溶液里含有的溶质为NaCl。
②设生成的氢氧化镁沉淀的质量为x,则
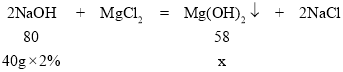
![]() =
=![]() 解得:x=0.58g
解得:x=0.58g
则所得不饱和溶液的质量=100g+10g+40g0.58g=149.4g