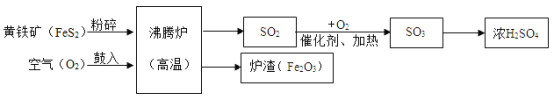
题目内容
【题目】如图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液 pH 随滴入溶液体积变化的曲线。

(1)氢氧化钠和盐酸恰好完全反应时,溶液的 pH_____7 (填“大于”或“小于”或“等于”),该反应的化学方程式为_____。
(2)根据曲线判断,该反应是将_____(填“氢氧化钠”或“盐酸”)滴入另一种物质中。
(3)当滴入溶液的体积为 5mL 时,此时该溶液中的溶质是_____(填化学式)。
(4)将 80g 10%的氢氧化钠溶液与一定质量的 10%的稀盐酸相混合,充分振荡后,滴入几滴石蕊溶液,溶液呈紫色,则稀盐酸的质量为_____。
【答案】等于 NaOH+HCl=NaCl+H2O 氢氧化钠 HCl和NaCl 73g
【解析】
(1)氢氧化钠和盐酸恰好完全反应时生成氯化钠溶液,显中性,溶液的 pH等于7 ,该反应的化学方程式为:NaOH+HCl=NaCl+H2O。
(2)根据曲线判断,未滴入溶液时,原溶液pH<7,显酸性,该反应是将氢氧化钠滴入稀盐酸溶液。
(3)当滴入溶液的体积为 5mL 时,混合溶液的pH<7,氢氧化钠和盐酸反应生成氯化钠溶液,且稀盐酸过量,此时该溶液中的溶质是:HCl和NaCl;
(4)将 80g 10%的氢氧化钠溶液与一定质量的 10%的稀盐酸相混合,充分振荡后,滴入几滴石蕊溶液,溶液呈紫色,说氢氧化钠与稀盐酸恰好完全反应,
解:设稀盐酸溶质的质量为x。

![]() x=7.3g
x=7.3g
稀盐酸的质量为=![]() 。
。

【题目】钥匙是生活中常用的一种开锁工具,如图是生活中常见的几种钥匙及其材料。
实物图片 |
|
|
|
材料成分 | 不锈钢 | 铁、塑料 | 塑料、铜锌合金 |
(1)所示材料中属于合成材料的是_______________,属于金属材料的是_______________。(填一种即可)
(2)锈蚀的锁,往锁孔里加人一些从铅笔芯上刮下的粉末,有利于锁的开启。这是因为____________。 生活中防止铁生锈的方法很多,请你举出一种常用的防锈方法:______________。
(3)现代生活中广泛用塑料代替钢和其他合金,其原因是______________。 (写一点即可)
(4)为比较锌、铁、铜的活动性顺序,下列方案中选取药品合理的是______________。
A锌、铁、CuSO4溶液
B锌、铜、FeSO4溶液
C锌、CuSO4溶液、FeSO4溶液
D铁、ZnSO4溶液、CuSO4溶液
【题目】某实验小组为了测定实验中氯酸钾样品的纯度,取一定质量的该样品与1g二氧化锰混合,其总质量为6g。依次加热该混合物T1、T2、T3、T4时间后,分别冷却称量剩余固体质量,记录的有关数据见下表:
加热时间 | T1 | T2 | T3 | T4 |
剩余固体质量 | 4.24g | 4.16g | 4.08g | 4.08g |
反应的化学方程式为:2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
(1)完全反应后,产生的氧气的总质量为________,你的依据是_____________。
(2)样品中氯酸钾的纯度是多少?_____(氯酸钾样品纯度是指样品中氯酸钾的质量分数)