题目内容
【题目】回答下列问题:
(1)黄铁矿为原料(主要成分是FeS2) 为原料,生产硫酸的简要流程图如下:
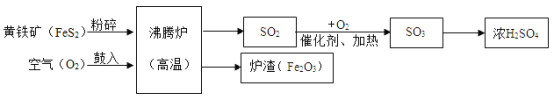
①黄铁矿中铁为+2价,则硫元素化合价是_________________。
②将黄铁矿粉碎,目的是_________________。
③实验室将所得浓硫酸稀释方法是_________________。
(2)A为含三种元素的钠盐,C为相对分子质量为100白色不溶物,请填空:
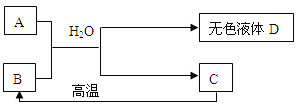
①B为食品干燥剂其化学式为___________________________;所有的转化关系中属于复分解反应的方程式为________________________________。
②要得到无色溶液D和固体C的方法是___________________________。
③无色溶液D中必定有的溶质为___________,请你设计实验证明无色溶液D中还有溶质A, ______。
【答案】-1 增大反应物接触面积,从而增大反应速率 把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌 CaO Na2CO3+Ca(OH)2=CaCO3↓+2NaOH 过滤 NaOH 取少量无色溶液D于试管中,滴加少量氯化钙溶液,如果有白色沉淀生成,证明含有碳酸钠
【解析】
氢氧化钙由氧化钙与水反应所得,化学方程式为CaO+H2O═Ca(OH)2;
验证溶液中含有碳酸根离子,可向溶液中滴加可溶性钙盐、可溶性钡盐或稀盐酸,如有沉淀生成或气体生成,则证明溶液中含有碳酸根离子。
(1)①二硫化亚铁(FeS2)中铁元素的化合价为+2价,根据化合物中各元素正负化合价的代数和为零,设硫元素的化合价为x,则(+2)+2x=0,解得x=-1,所以二硫化亚铁(FeS2)中硫元素的化合价为-1价;故填:-1;
②反应物颗粒越小,反应时接触面积越大,反应速率越快,所以将黄铁矿粉碎,目的是增大反应物接触面积,从而增大反应速率;故填:增大反应物接触面积,从而增大反应速率;
③稀释浓硫酸的正确操作是:稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌;故填:把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌;
(2)根据C为相对分子质量为100的白色不溶物,所以C可能为碳酸钙,碳酸钙高温分解生成氧化钙和二氧化碳,B、A和水反应生成碳酸钙,A为含三种元素的钠盐,所以B为CaO,A与B反应生成碳酸钙和D,利用守恒可知A中含碳酸根,又知A为含三种元素的钠盐,所以A为碳酸钠,D为碳酸钠和氢氧化钙反应生成的氢氧化钠。经验证,推导正确。
①B为氧化钙,可用于食品干燥剂,化学式为CaO;A、B和水反应是氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,属于复分解反应,碳酸钙高温煅烧生成二氧化碳和氧化钙,属于分解反应;故填:CaO;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
②要将无色溶液D和固体C分离,方法是过滤;故填:过滤;
③D溶液为碳酸钠和氢氧化钙反应后所形成的溶液,依据Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,反应后溶液一定含有NaOH;要证明无色溶液D中还有溶质碳酸钠,可以取少量无色溶液D于试管中,滴加少量氯化钙溶液,如果有白色沉淀生成,证明含有碳酸钠。因为碳酸钠和氯化钙反应生成碳酸钙沉淀。故填:NaOH;取少量无色溶液D于试管中,滴加少量氯化钙溶液,如果有白色沉淀生成,证明含有碳酸钠。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案【题目】某校兴趣小组在实验室中完成制取氧气的实验。他们取氯酸钾和二氧化锰的混合物共3.0g放入大试管中加热,并在不同时刻测定试管内剩余固体物质的质量(如下表):
反应时间/min | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 |
剩余固体质量/g | 2.55 | 2.25 | 2.10 | 2.04 | 2.04 |
分析表中数据,完成下列问题:
(1)完全反应后,生成氧气的质量为_______________g;
(2)原混合物中氯酸钾的质量是多少?_____________