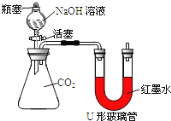
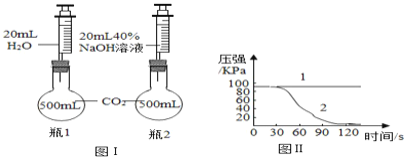
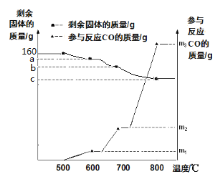
��Ŀ����
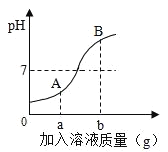
����Ŀ����ͼ��A��B��C���ֹ������ʵ��ܽ�����ߡ�
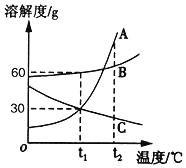
��1��t1��ʱ��B�����ܽ����_____��
��2��t1��ʱ����20gA����Ͷ��50gˮ�У�����ܽ��ɵõ�����_____��Һ��������������������������������ȷ��������
��3�����������ʵ���������Ϊ37.5%��B��Һ��Ӧ������¶ȷ�Χ��_____��
��4������˵����ȷ����_______
A�����������ܽ�ȴ�С����Ϊ��A��B��C
B��t2��ʱ��A��B��C�ı�����Һ�����µ�t1��ʱ����Һ�����ʵ����������Ĵ�С˳��Ϊ��B��A��C
C�����¶���t2�潵��t1��ʱ������A��������B��
D�������͵�C��Һ�к�����������A���ɲ������½ᾧ�ķ����ᴿC
���𰸡�60g ���� t1<t BD
��������
A���ʵ��ܽ�����¶ȵ����Ӷ�����B���ʵ��ܽ�����¶ȵ���������������C���ʵ��ܽ�����¶ȵ����Ӷ���С�������ʾ���ʵ��ܽ����ͬ��������������Һ������ͬ���¶ȣ��ܽ�ȱ仯�����������࣬������Һ�����ʵ������������㹫ʽΪ![]() ��
��
��1��t1��ʱ��B�����ܽ����60g��
��2��t1��ʱ��A���ܽ����30g����100gˮ������ܽ�30gA����20gA����Ͷ��50gˮ�У���50gˮ�п����ܽ�A���ʵ�����Ϊ![]() �������ܽ��ɵõ��DZ�����Һ��
�������ܽ��ɵõ��DZ�����Һ��
��3�� ���ݱ�����Һ�����������㹫ʽ![]() �����������ʵ���������Ϊ37.5%��B��Һ��Ӧ������¶ȷ�Χ��t1<t��
�����������ʵ���������Ϊ37.5%��B��Һ��Ӧ������¶ȷ�Χ��t1<t��
��4��A���Ƚ����ʵ��ܽ�ȴ�С������ȷ���¶ȣ���Ϊ���ʵ��ܽ�ȴ�С���¶Ȳ��ϱ仯����A����ȷ��
B��t2��ʱ�������ʵ��ܽ�ȴ�С��ϵ��A>B>C���䱥����Һ���µ�t1��ʱ������AB���ܽ�����¶ȵĽ��ͼ�С��C���ܽ�����¶ȵĽ��Ͷ��������Խ�����t1��ʱAB��Ȼ���ͣ�C�ܽ������Ϊ��������Һ���������������뽵��ǰ��ȣ�������Һ�����ʵ������������㹫ʽΪ![]() �����ܽ�ȴ����������������t1��ʱB���ܽ�ȴ���A���ܽ�ȴ���C���ܽ�ȣ�����������������B>A>C����B��ȷ��
�����ܽ�ȴ����������������t1��ʱB���ܽ�ȴ���A���ܽ�ȴ���C���ܽ�ȣ�����������������B>A>C����B��ȷ��
C. ���¶���t2������t1��ʱ����֪��AB������Һ������������A��������B���������жϣ���C����ȷ��
D��A���ܽ�����¶ȵ����߶�����C���ܽ�����¶ȵ����߶���С�����Ա��͵�C��Һ�к�����������A���ɲ������½ᾧ�ķ����ᴿC����C��ȷ����ѡBD��