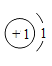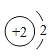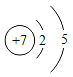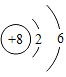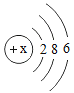题目内容
【题目】了解物质的结构,有利于理解和认识化学问题.
(1)下表为部分元素的原子结构示意图.
元素名称 | 氢 | 氦 | 氮 | 氧 | 钠 | 硫 |
元素符号 | H | He | N | O | Na | S |
原子结构示意图 |
|
|
|
|
|
|
①表中硫原子的核电荷数x为_____,硫原子得到两个电子所形成离子的符号为_____.
②表中具有相对稳定结构的原子是_____(填元素符号).
③表中所列6种元素中,位于第三周期的非金属元素有_____种.
④钠元素与硫元素可形成化合物硫化钠,该化合物的化学式为_____.
⑤氮元素在元素周期表中的信息如图所示,下列说法错误的是(____)
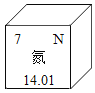
a 氮原子的质子数为7 b 氮元素的相对原子质量为14.01g c 氮原子最外层电子数为7
(2)如图是某反应的微观过程示意图,其中“![]() ”“
”“![]() ”表示两种不同的原子.
”表示两种不同的原子.
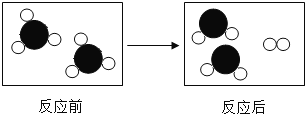
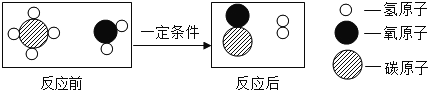
请根据图示回答:①该反应的基本类型是_____.
②在该反应前后肯定没有变化的是_____.(填序号)
A原子数目 B分子数目 C元素种类 D物质的总质量
【答案】16 S2- He 1 Na2S bc 分解反应 ACD
【解析】
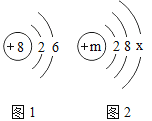
解:(1)①在原子中质子数等于电子数,所以表中硫原子的核电荷数x为:2+8+6=16,硫原子得到两个电子所形成的离子为硫离子,符号为:S2-;
②氦的原子核外只有一个电子层,排布了2个电子,达到了稳定结构,原子的符号为:He;
③表中所列6种元素中,只有硫的核外有三个电子层,位于第三周期,属于非金属元素;
④钠元素的化合价为+1价,与硫元素形成化合物时硫显-2价,该化合物的化学式为:Na2S;
⑤a.氮原子的质子数为7,说法正确;
b.相对原子质量的单位为“1”,不是“g”,说法错误;
c.氮原子最外层电子数为5,不是7,说法错误;
(2)①由图示可知反应前含有一种分子即为一种物质,反应后存在两种分子即为两种物质,符合分解反应“一变多”的特性,因此为分解反应;
②A、观察微观示意图可知反应前后原子的数量均不变化,故说法正确;
B、反应前分子的数目是2个,反应后是3个,因此分子的数目发生了变化,故说法错误;
C、原子的种类不变,因此元素的种类也不变,故说法正确;
D、根据质量守恒定律,物质的总质量不变,故说法正确。

【题目】某化学兴趣小组探究浓硫酸与木炭反应后气体的成分。提出猜想:从物质组成元素角度分析,产生的气体可能是二氧化硫、二氧化碳和水。
查阅资料
(1)二氧化硫可使澄清石灰水变浑浊。
(2)二氧化硫可使品红溶液的红色褪去,而二氧化碳不能,以此检验二氧化硫。
(3)二氧化硫能被酸性高锰酸钾溶液吸收,而二氧化碳不能。
实验装置
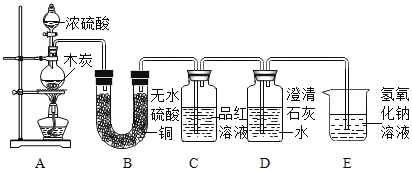
实验记录
序号 | 实验现象 | 实验结论 |
I | B中白色固体变成蓝色固体 | 产物中有水 |
II | C中品红溶液褪色 | 产物中有二氧化硫 |
III | D中澄清石灰水变浑浊 | 产物中有二氧化碳 |
交流与反思
(1)某同学认为结论 III不合理,原因是___________________。
(2)通过研究,小组对实验进行了改进:增加一个装有酸性高锰酸钾溶液的试剂瓶F.改进后实验装置的连接顺序为__________________________(填字母,实验装置可重复使用)。能确定产物中有二氧化碳的实验现象是________________________。
(3)经进一步确定,浓硫酸和木炭反应后的产物只有二氧化硫、二氧化碳和水,写出该反应的化学方程式______________________________。
【题目】元素周期表是学习化学的重要工具。如下图是元素周期表的一部分,据此回答下列问题。
(1)在化学反应中,铝元素的原子容易__________形成铝离子。铝位于第______周期。
(2)同一周期元素的原子,最外层电子数的特点是:___________________________。
1 H 1.008 | 2 He 4.003 | ||||||
3 Li 6.941 | 4 Be 9.012 | 5 B 10.81 | 6 C 12.01 | 7 N 14.01 | 8 O 16.00 | 9 F 19.00 | 10 Ne 20.18 |
11 Na 22.99 | 12 Mg 24.31 | 13 Al 26.98 | 14 Si 28.09 | 15 P 30.97 | 16 S 32.06 | 17 Cl 35.45 | 18 Ar 39.95 |
(3)氧元素的原子结构示意图为如图,某元素与氧元素的化学性质相似,该元素的原子结构示意图为如图,则x=_____,m=_____。