题目内容
【题目】某兴趣小组同学用下图所示装置探究碳单质和化合物的性质。已知由一氧化碳发生装置得到的CO中混有少量CO2和H2O.
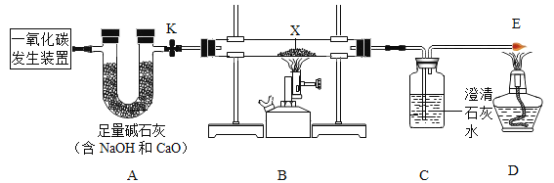
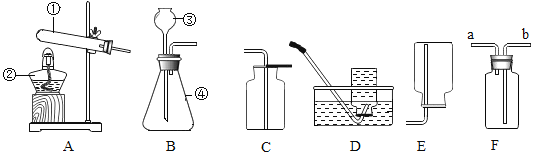
实验一:探究一氧化碳的还原性。按图23装置进行实验,X处放入氧化铜,打开活塞k,通入发生装置中的气体一会,点燃B、D处的酒精灯。
(1) A装置的作用是__________________。
(2) B中玻璃管内发生反应的化学方程式为___________________,证明一氧化碳有还原性的现象是_________。
(3)若通过该实验测铜的相对原子质量,实验中需要获得的数据是_________________。
实验二:探究碳和氧化铜的反应。
(查阅资料)
①碳还原氧化铜时,在一定条件下反应生成铜,或同时生成少量的氧化亚铜(Cu2O);
②Cu2O和Cu都为红色固体,且Cu2O能与稀硫酸反应,反应的化学方程式为![]() .
.
(实验探究)按上图装置进行实验(关闭活塞k)。
(1)取一定质量比的木炭粉和氧化铜的混合物放入X处进行实验,观察到黑色粉末变为红色,经检验红色固体为铜,则X处发生反应的化学方程式为____________________。
(2)另取一定质量比的木炭粉和氧化铜的混合物放入X处进行实验,观察到黑色粉末变为红色,为确定红色固体成份设计了如下实验。称量实验后的红色固体质量为mg,并置于烧杯中, 进行实验,请完成下表内容。
实验操作 | 实验现象 | 实验结论 | 结论解释 |
____________ | 溶液变蓝色有红色固体 | ____________ | ____________ |
(实验结论)一定条件下,碳能还原氧化铜且反应物比例不同,可能生成物不同。
【答案】除去二氧化碳和水蒸气 CuO+CO![]() Cu+CO2 B中黑色固体变红色,C中澄清石灰水变浑浊 B中固体质量差、C中增加的质量; 2CuO+C
Cu+CO2 B中黑色固体变红色,C中澄清石灰水变浑浊 B中固体质量差、C中增加的质量; 2CuO+C![]() 2Cu+CO2↑ 把适量实验后的红色固体放于试管中,加入足量稀硫酸 红色固体是铜和氧化亚铜 铜不能和稀硫酸反应,氧化亚铜和稀硫酸反应生成了硫酸铜
2Cu+CO2↑ 把适量实验后的红色固体放于试管中,加入足量稀硫酸 红色固体是铜和氧化亚铜 铜不能和稀硫酸反应,氧化亚铜和稀硫酸反应生成了硫酸铜
【解析】
实验一:
(1)氢氧化钠易吸水而潮解,氧化钙易与水反应生成氢氧化钙,所以碱石灰有吸水性,同时,氢氧化钠和氢氧化钙都能和二氧化碳反应,故碱石灰还能吸收二氧化碳,即A装置的作用是除去二氧化碳和水蒸气;
(2)B中玻璃管内氧化铜和一氧化碳在加热条件下反应生成铜和二氧化碳,发生反应的化学方程式为:CuO+CO![]() Cu+CO2,氧化铜是黑色固体,铜是红色固体,二氧化碳和氢氧化钙反应生成碳酸钙沉淀,所以证明一氧化碳有还原性的现象是:B中黑色固体变红色,C中澄清石灰水变浑浊;
Cu+CO2,氧化铜是黑色固体,铜是红色固体,二氧化碳和氢氧化钙反应生成碳酸钙沉淀,所以证明一氧化碳有还原性的现象是:B中黑色固体变红色,C中澄清石灰水变浑浊;
(3)若通过该实验测铜的相对原子质量,实验中需要获得的数据是B中固体质量差(反应的氧化铜中氧元素质量,根据氧元素质量可以计算反应的氧化铜质量)、C中增加的质量(反应生成的二氧化碳质量,根据反应的化学方程式、反应的氧化铜质量、生成二氧化碳的质量、氧原子相对原子质量可以计算铜原子相对原子质量);
实验二:
(1)观察到黑色粉末变为红色,经检验红色固体为铜,则X处高温条件下氧化铜和碳反应生成铜和二氧化碳,发生反应的化学方程式为:2CuO+C![]() 2Cu+CO2↑;
2Cu+CO2↑;
(2)把适量实验后的红色固体放于试管中,加入足量稀硫酸,溶液变蓝色、有红色固体,说明氧化亚铜和稀硫酸反应生成硫酸铜和水,实验过程如下所示:
实验操作 | 实验现象 | 实验结论 | 结论解释 |
把适量实验后的红色固体放于试管中,加入足量稀硫酸 | 溶液变蓝色、有红色固体 | 红色固体是铜和氧化亚铜 | 铜不能和稀硫酸反应,氧化亚铜和稀硫酸反应生成了硫酸铜 |