题目内容
【题目】化学与生活息息相关。
(1)下列食品所富含的主要营养素是___________。

(2)下列疾病中,与缺少钙元素有关的是___________(填字母序号)。
A骨质疏松 B坏血病 C佝偻病 D贫血 E大脖子病
(3)某河道两旁有甲乙两厂,它们排放的工业废水都澄清透明且共含 K+、Ag+、Fe3+、Cl-、OH-、NO3-六种离子。甲厂的废水明显呈碱性,故甲厂废水中含有的三种离子是___________。乙厂的废水中含有另三种离子,如果加一定量___________(选填:活性炭、硫酸亚铁、铁粉),可以回收其中的金属____________(填写金属元素符号),另一种设 想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的部分离子转化为沉淀。经过滤后的废水主要含___________(填化学式),它是一种___________。(填“氮 肥”。“钾肥”或“复合肥”),可用来浇灌农田。
(4)二氧化硅(SiO2)和二氧化碳性质相似。玻璃(含二氧化硅)瓶身经抛光处理,不易反应,而瓶口和玻璃塞上的磨砂将二氧化硅裸露出来。二氧化硅能与氢氧化钠溶液反应生成硅酸钠(Na2SiO3),其化学方程式为___________。
【答案】维生素 AC Cl-、OH-和K+ Fe Ag 硝酸钾 复合肥 ![]()
【解析】
(1)蔬菜、水果中富含维生素,故填:维生素;
(2)缺少钙元素成人会的骨质疏松症,儿童会得佝偻病,故选:AC;
(3)氢氧根离子和铁离子和银离子不能共存,氯离子和银离子不能共存,溶液中一定有阴阳离子。由题目信息,甲厂的废水明显呈碱性,一定有氢氧根离子,一定没有银离子和铁离子,它们都在乙厂;那么氯离子在甲厂;甲厂不能没有阳离子故K+必须在甲厂,甲厂废水中含有的三种离子是: Cl-、OH-和K+;乙厂的离子有:Ag+、Fe3+、NO3-;铁的金属活动性比银强,乙厂中加入铁粉可以回收银;甲厂和乙厂的废水按适当的比例混合,生成氢氧化铁红褐色沉淀和氯化银白色沉淀,溶液中的溶质是硝酸钾,它含有钾元素、氮元素是一种复合肥。
(4)二氧化硅能与氢氧化钠溶液反应生成硅酸钠(Na2SiO3)化学方程式为:
![]() ;
;

 心算口算巧算一课一练系列答案
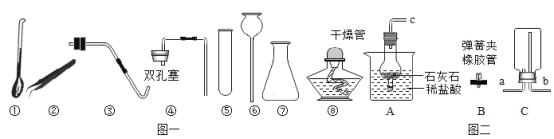
心算口算巧算一课一练系列答案【题目】某兴趣小组同学用下图所示装置探究碳单质和化合物的性质。已知由一氧化碳发生装置得到的CO中混有少量CO2和H2O.
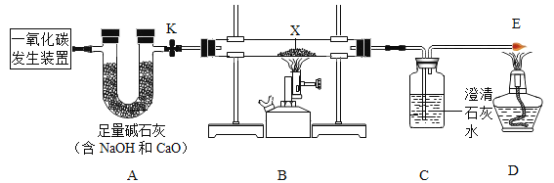
实验一:探究一氧化碳的还原性。按图23装置进行实验,X处放入氧化铜,打开活塞k,通入发生装置中的气体一会,点燃B、D处的酒精灯。
(1) A装置的作用是__________________。
(2) B中玻璃管内发生反应的化学方程式为___________________,证明一氧化碳有还原性的现象是_________。
(3)若通过该实验测铜的相对原子质量,实验中需要获得的数据是_________________。
实验二:探究碳和氧化铜的反应。
(查阅资料)
①碳还原氧化铜时,在一定条件下反应生成铜,或同时生成少量的氧化亚铜(Cu2O);
②Cu2O和Cu都为红色固体,且Cu2O能与稀硫酸反应,反应的化学方程式为![]() .
.
(实验探究)按上图装置进行实验(关闭活塞k)。
(1)取一定质量比的木炭粉和氧化铜的混合物放入X处进行实验,观察到黑色粉末变为红色,经检验红色固体为铜,则X处发生反应的化学方程式为____________________。
(2)另取一定质量比的木炭粉和氧化铜的混合物放入X处进行实验,观察到黑色粉末变为红色,为确定红色固体成份设计了如下实验。称量实验后的红色固体质量为mg,并置于烧杯中, 进行实验,请完成下表内容。
实验操作 | 实验现象 | 实验结论 | 结论解释 |
____________ | 溶液变蓝色有红色固体 | ____________ | ____________ |
(实验结论)一定条件下,碳能还原氧化铜且反应物比例不同,可能生成物不同。