题目内容
用CO通入4克加热的赤铁矿粉(主要成分是Fe203)待反应完成后,测得残余固体的质量为3.04克,则有________克铁被还原出来.
2.24
分析:根据CO还原氧化铁的实验现象,反应完成后残余固体为氧化铁失氧后所得的金属铁及矿石中不反应的杂质,可判断反应前后固体物质质量差实为氧化铁中氧元素质量,利用氧化铁的化学式可求得该化合物中铁与氧的质量关系,由此可计算出剩余固体中还原出铁的质量.
解答:根据质量守恒定律,氧化铁中氧元素质量=4g-3.04g=0.96g
氧化铁Fe2O3中铁、氧元素质量比=(56×2):(16×3)=7:3,
则氧化铁中铁的质量=0.96g×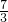 =2.24g
=2.24g
故答案为:2.24.
点评:根据变化前后元素质量不变,得出反应前后固体质量差为氧化铁中氧元素质量是解答本题的突破口.
分析:根据CO还原氧化铁的实验现象,反应完成后残余固体为氧化铁失氧后所得的金属铁及矿石中不反应的杂质,可判断反应前后固体物质质量差实为氧化铁中氧元素质量,利用氧化铁的化学式可求得该化合物中铁与氧的质量关系,由此可计算出剩余固体中还原出铁的质量.
解答:根据质量守恒定律,氧化铁中氧元素质量=4g-3.04g=0.96g
氧化铁Fe2O3中铁、氧元素质量比=(56×2):(16×3)=7:3,
则氧化铁中铁的质量=0.96g×
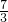 =2.24g
=2.24g故答案为:2.24.
点评:根据变化前后元素质量不变,得出反应前后固体质量差为氧化铁中氧元素质量是解答本题的突破口.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
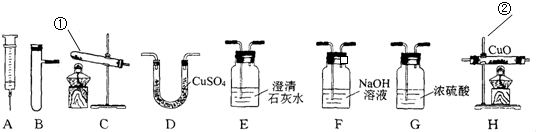
 用如图所示装置测定某铁的氧化物中铁元素和氧元素的质量比,记录如下:
用如图所示装置测定某铁的氧化物中铁元素和氧元素的质量比,记录如下: