题目内容
【题目】金属是人类生活中的常用的材料.
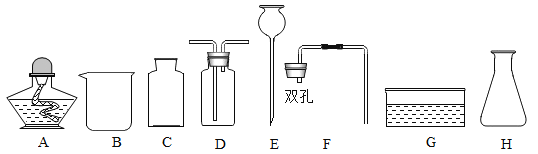
(1)下列生活用品中,主要利用金属导热性的是____(填字母序号).

(2)工业上用赤铁矿(主要成分是氧化铁)冶炼铁的化学方程式是___________________________.
(3)现有锌片、铜片、稀硫酸、硫酸锌溶液和硫酸铜溶液5种物质,某同学欲探究锌和铜的金属活动性顺序,选择的一组试剂是____________________,其现象是__________________________________.
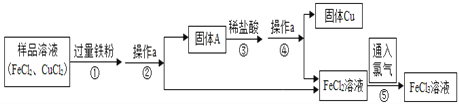
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),他以铜锈为原料设计并完成如下实验(杂质不与稀硫酸反应,且不含铜元素.图中部分物质略去).
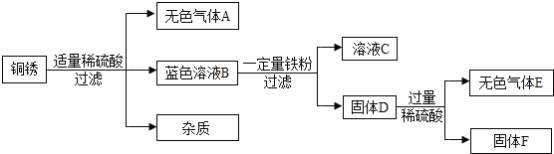
①溶液C中所含的溶质是________________________.
②已知铜锈中Cu2(OH)2CO3的质量分数是10%,固体F的质量是1.28g,则铜锈中含Cu的质量分数是
__(结果精确至0.1%).
【答案】AB 3CO+Fe2O3![]() 2Fe+3CO2 锌片、铜片、稀硫酸(答案不唯一) 锌片与稀硫酸反应有气体放出,铜片与稀硫酸没有气体放出 FeSO4 5.8%.
2Fe+3CO2 锌片、铜片、稀硫酸(答案不唯一) 锌片与稀硫酸反应有气体放出,铜片与稀硫酸没有气体放出 FeSO4 5.8%.
【解析】
(1)铁锅是利用金属的导热性,铜制火锅是利用金属的导热性,铝制易拉罐是利用金属的延展性;
(2)一氧化碳具有还原性,能与氧化铁反应生成铁和二氧化碳,反应的化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(3)根据金属活动性顺序表,一般情况下,排在氢前的金属可以与稀硫酸(或盐酸)发生置换反应,排在氢后的金属不能与稀硫酸(或盐酸)发生置换反应,除非常活泼的金属外,排在前面的金属一般可以将排在后面的金属从它们的盐溶液中置换出来,要设计实验验证锌和铜的活动性强弱,①可以利用锌在氢前而铜在氢后,氢前金属能与稀硫酸反应产生氢气,氢后金属不能与稀硫酸反应产生氢气的性质设计实验选择试剂。故填:锌片、铜片、稀硫酸 锌片与稀硫酸反应有气体放出,铜片与稀硫酸没有气体放出;②可以利用锌与硫酸铜溶液发生置换反应,现象是锌的表面有红色物质;③利用铜片与硫酸锌溶液,无明显现象
(4)铜锈能与稀硫酸反应生成二氧化碳和硫酸铜,硫酸铜能与铁反应生成硫酸亚铁和铜,故C中一定含有硫酸亚铁,得到的固体D能与酸反应生成气体,则D中含有铁和铜,得到的固体F是铜,在一个碱式碳酸铜分子中含有两个铜原子,故其质量关系为Cu2(OH)2CO3~2Cu,
设:碱式碳酸铜的质量为x。

![]() x=2.22g
x=2.22g
则铜锈的质量=![]()
故铜锈中铜元素的质量分数=![]() 。
。

【题目】试用两种不同的方法鉴别两瓶无色液体:蒸馏水和氢氧化钠溶液
方法 | 实验步骤 | 实验现象 | 结论 |
方法一:物理方法 | 分别取样于试管中 ______ | ______ ; ______ | 该物质是蒸馏水; 该物质是氢氧化钠溶液 |
方法二:化学方法 | 分别取样于试管中 ______ | ______ ; ______ | 该物质是蒸馏水; 该物质是氢氧化钠溶液 |
【题目】铁是世界上使用最广的金属材料。
请从A或B两题中任选1个作答,若两题均作答,按A计分。
A | B |
(1)铁能制成铁锅,这是利用金属铁具有良好的________。 (2)工业生产常用10%的稀盐酸来除铁 锈,写出该除锈反应的化学反应方程式________。 | (1)铁锅清洗后及时擦干放置,可以减少________对铁锈蚀的影响。 (2)工业常用赤铁矿和一氧化碳在高温条件下炼铁,该反应的化学方程式为_______。 |
【题目】在小英家的仓库里,堆放着一袋袋碳酸氢铵(NH4HCO3)。过了一个夏天,小英发现这种化肥所特有的刺激性气味变得更浓烈了,有些化肥袋里碳酸氢铵变少了。检查发现,变少的化肥包装袋没有密封,化肥也没有撒落在地上,更没有人进过仓库开袋使用。为了探究这些化肥减少的原因,小英在实验室取了一些碳酸氢铵粉末,放在蒸发皿中加热,过一会儿观察到粉末完全消失,同时也闻到了这种刺激性气味。粉末为什么会消失呢?
[提出问题] 碳酸氢铵粉末消失的原因是什么?
[猜想]
①碳酸氢铵粉末在不加热或加热条件下由固态变成它的气态。
②碳酸氢铵在不加热或加热条件下发生分解反应,可能产生的物质有氨气和其他物质。
[查阅资料]
(1)碳酸氢铵属于氮肥,不具有升华的性质,说明上述猜想______(填序号)不成立。
(2)氨气(NH3)具有特殊的刺激性气味,极易溶于水,能使湿润的红色石蕊试纸变蓝。
(3)二氧化氮(NO2)为红棕色气体,一氧化氮(NO)为无色气体,在空气中易发生反应:![]() 。
。
[进行实验]
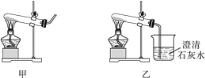
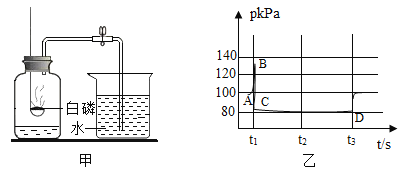
实验操作 | 实验现象 | 实验结论 |
Ⅰ.取适量碳酸氢铵于试管中加热,如图7甲所示,将干燥的红色石蕊试纸接近导管口 | 产生强烈的刺激性气味,试管壁上有无色液滴且试纸变蓝,但未见红棕色气体 | 分解产物中有______和______,没有________或一氧化氮 |
Ⅱ.按图乙所示装置继续实验,直到反应完全 | 澄清石灰水变浑浊 | 分解产物中有__________ |
[应用]
(1)利用氨气的化学性质,检验一集气瓶内气体是不是氨气。
实验操作 | 实验现象 | 实验结论 |
__________________ | __________________ | 集气瓶内气体为氨气 |
(2)如果你家里有碳酸氢铵化肥,你应该如何保存?______________________。